
| A. | $\frac{x}{28}$ | B. | 14x mol-1 | C. | 28x mol-1 | D. | 28x |
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
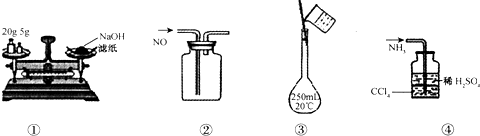
| A. | ①称量氢氧化钠固体 | B. | ②收集NO气体 | ||
| C. | ③配制100 mL 0.10 mol•L-1盐酸 | D. | ④吸收NH3不会造成倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| B. | 氯化铵和碘都可以用加热的方法进行提纯 | |
| C. | 氯水、SO2均能使品红溶液褪色 | |
| D. | 溴蒸汽和NO2气体都能使湿润的淀粉碘化钾试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
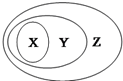 X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是
X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是| X | Y | Z | |
| A | 碱 | 氧化物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{25}{2a}$ mol•L-1 | B. | $\frac{125}{2a}$mol•L-1 | C. | $\frac{125}{4a}$mol•L-1 | D. | $\frac{75}{2a}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e+=Fe3+,继而形成铁锈 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的负极相连接,正极连接到一个废铁上可防止水闸被腐蚀 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com