
 与HCN反应引入:
与HCN反应引入: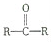 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$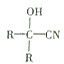
 $→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D
$→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D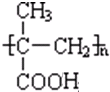 .
.分析 根据题干信息:反应①为引入-CN,发生加成反应为:CH3COCH3+HCN$\stackrel{一定条件}{→}$ CH3C(OH)(CH3)CN,所以A为CH3C(OH)(CH3)CN,A在酸性条件下水解生成羧酸,反应为:CH3C(OH)(CH3)CN$\stackrel{H_{2}O、H+}{→}$ CH3C(OH)(CH3)COOH,所以B为CH3C(OH)(CH3)COOH,在浓硫酸加热的条件下,醇羟基脱水生成烯烃CH2=C(CH3)COOH,烯烃含有碳谈双键发生加聚反应生成D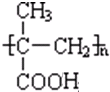 ,
,
(1)根据反应①、反应④分别书写A、D的结构简式;
(2)根据B的结构简式分析,B为CH3C(OH)(CH3)COOH含有羟基、羧基;
(3)反应①为引入-CN,发生加成反应,反应③B→C的醇羟基的消去反应;
(4)B为CH3C(OH)(CH3)COOH,在浓硫酸加热的条件下,醇羟基脱水生成烯烃.
解答 解:根据题干信息:反应①为引入-CN,发生加成反应,所以反应①为:CH3COCH3+HCN$\stackrel{一定条件}{→}$ CH3C(OH)(CH3)CN,A为CH3C(OH)(CH3)CN,A在酸性条件下水解生成羧酸,反应②A→B为:CH3C(OH)(CH3)CN$\stackrel{H_{2}O、H+}{→}$ CH3C(OH)(CH3)COOH,所以B为CH3C(OH)(CH3)COOH,在浓硫酸加热的条件下,醇羟基脱水生成烯烃,所以反应③B→C为:CH3C(OH)(CH3)COOH$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+H2O,烯烃含有碳碳双键发生加聚反应生成高聚物,反应④C→D为:CH2=C(CH3)COOH$\stackrel{催化剂}{→}$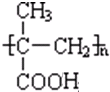 ,
,
(1)反应①为:CH3COCH3+HCN$\stackrel{一定条件}{→}$ CH3C(OH)(CH3)CN,A为CH3C(OH)(CH3)CN,反应④C→D为:CH2=C(CH3)COOH$\stackrel{催化剂}{→}$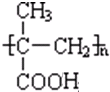 ,D为:
,D为: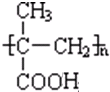 ,
,
故答案为:CH3C(OH)(CH3)CN;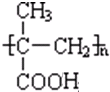 ;
;
(2)反应②A→B为:CH3C(OH)(CH3)CN$\stackrel{H_{2}O、H+}{→}$ CH3C(OH)(CH3)COOH,所以B为CH3C(OH)(CH3)COOH,含有醇羟基、羧基,
故答案为:醇羟基、羧基;
(3)反应①为引入-CN,发生加成反应,所以反应①为:CH3COCH3+HCN$\stackrel{一定条件}{→}$ CH3C(OH)(CH3)CN,B为CH3C(OH)(CH3)COOH,在浓硫酸加热的条件下,醇羟基脱水发生消去反应生成烯烃,反应③B→C为:CH3C(OH)(CH3)COOH$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+H2O,
故答案为:加成反应;消去反应;
(4)反应③B→C为:CH3C(OH)(CH3)COOH$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+H2O,
故答案为:CH3C(OH)(CH3)COOH$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+H2O.
点评 本题考查了有机物的推断,根据物质含有的官能团推测其具有的性质,结构决定性质,答题时注意充分运用题中信息,注意有官能团的变化,题目难度中等.


科目:高中化学 来源: 题型:选择题
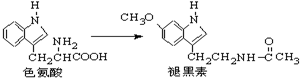
| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 | |
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 | |
| C. | 在一定条件下,色氨酸可发生缩聚反应 | |
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com