
����Ŀ������������Ũ�Ⱦ�Ϊ1��10��3 mol/L�ļ�����Һ�������ᡢ�����ᡢ�۴��ᡢ������李��ݰ�ˮ��������������Һ���ش��������⣺
��1����ˮ�ĵ��뷽��ʽΪ_______���������ˮ��Һ��ˮ������ӷ���ʽΪ___________��
��2�����ۡ���Ϻ�����Һ�����ԣ�����������Һ�����Ϊ��________�ޣ����������=������������Һ�е�����Ũ���ɴ�С��˳��Ϊ____________________________��
��3����ij�¶��£�Kw=1��10��12������100 mL�Ģ���100 mL�Ģ���Һ��Ϻ����Ϻ���Һ�����Ϊ���ǰ����Һ�����֮�ͣ�����Һ��pH=_________��
��4������������Ģڡ�����Һ��������ͬ�¶Ⱥ���Һ��pH ��_______�ۣ������ ����=����������
��5������ʱ�����âٵζ��ݣ����˵�ָʾ��Ϊ_____�����ζ�������pH=9ʱ������Һ������4c(NH4+)=7c(NH3��H2O)����ˮ�ĵ���ƽ�ⳣ��Kb(NH3��H2O)=____������ֵ����
���𰸡�NH3��H2O![]() NH4+ + OH�� NH4+ + H2O
NH4+ + OH�� NH4+ + H2O ![]() NH3��H2O+H+ �� c(Na+)=c(CH3COO-)>c(H+)=c(OH-) 6 < ���� 1.75��10��5
NH3��H2O+H+ �� c(Na+)=c(CH3COO-)>c(H+)=c(OH-) 6 < ���� 1.75��10��5
��������
��1������һˮ�ϰ�Ϊ���������д���뷽��ʽ��笠�����Ϊ���������Ӻ�ˮ����������������ӽ������һˮ�ϰ��������ӣ�
��2��������Һ�����ͬ�������˴�������Һ����ʾ���������Դ���Ӧ�������Щ����Ӧ���pH����7�Ĵ�����������Һ�����ݵ���غ��������Ũ�ȴ�С��ϵ��
��3����100 mL��1��10��3 mol/L��������100 mL��1��10��3 mol/L������������Һǡ����ȫ��Ӧ����Һ�����ԣ�����Kw=1��10��12��c(H+)=1��10��6��pH=6��
��4�������������Ũ�ȵ����ᡢ������Һ�����������Ƕ�Ԫǿ�ᣬ���������ᣬ����ȫ���룬��Һ�е�c(H+)������ڴ��ᣬ������Һ��pH �ڣ��ۣ�
��5����1��10��3 mol/L������ζ�1��10��3 mol/L�İ�ˮ��ǡ����ȫ��Ӧʱ�����Ȼ�泥���Һ�����ԣ��������˵�ָʾ��Ϊ���ȣ����ζ�������pH=9ʱ����ҺΪһˮ�ϰ����Ȼ�淋Ļ����Һ����ˮ�ĵ���ƽ�ⳣ��Kb(NH3��H2O)=![]() ����4c(NH4+)=7c(NH3��H2O)��c(OH-)=10-5mol/L������ã�
����4c(NH4+)=7c(NH3��H2O)��c(OH-)=10-5mol/L������ã�
Kb(NH3��H2O)=![]() =1.75��10-5��
=1.75��10-5��
��1��NH3��H2OΪ������ʣ��������ֵ��룬���뷽��ʽΪNH3��H2O![]() NH4+ + OH����NH4+Ϊ���������Ӻ�ˮ����������������ӽ������һˮ�ϰ��������ӣ�ˮ������ӷ���ʽΪNH4+ + H2O
NH4+ + OH����NH4+Ϊ���������Ӻ�ˮ����������������ӽ������һˮ�ϰ��������ӣ�ˮ������ӷ���ʽΪNH4+ + H2O ![]() NH3��H2O+H+��
NH3��H2O+H+��
��ˣ�������ȷ��Ϊ��NH3��H2O![]() NH4+ + OH����NH4+ + H2O
NH4+ + OH����NH4+ + H2O ![]() NH3��H2O+H+��
NH3��H2O+H+��
��2��������Һ�����ͬ�������˴�������Һ����ʾ���������Դ���Ӧ�������Щ����������Һ�����Ϊ��>������Ӧ���pH����7�Ĵ�����������Һ�����ݵ���غ�c(Na+)=c(CH3COO-)>c(H+)=c(OH-)��
��ˣ�������ȷ��Ϊ��>��c(Na+)=c(CH3COO-)>c(H+)=c(OH-)��
��3����100 mL��1��10��3 mol/L��������100 mL��1��10��3 mol/L������������Һǡ����ȫ��Ӧ����Һ�����ԣ����ڴ�ʱKw=1��10��12����c(H+)=1��10��6��pH=6��
��ˣ�������ȷ��Ϊ��6��
��4�������������Ũ�ȵ����ᡢ������Һ�����������Ƕ�Ԫǿ�ᣬ���������ᣬ����ȫ���룬��Һ�е�c(H+)������ڴ��ᣬ������Һ��pH �ڣ��ۣ�
��ˣ�������ȷ��Ϊ������
��5����1��10��3 mol/L������ζ�1��10��3 mol/L�İ�ˮ��ǡ����ȫ��Ӧʱ�����Ȼ�泥���Һ�����ԣ��������˵�ָʾ��Ϊ���ȣ�
���ζ�������pH=9ʱ����ҺΪһˮ�ϰ����Ȼ�淋Ļ����Һ����ˮ�ĵ���ƽ�ⳣ��Kb(NH3��H2O)=![]() ������֪4c(NH4+)=7c(NH3��H2O)��c(OH-)=10-5mol/L������ã�
������֪4c(NH4+)=7c(NH3��H2O)��c(OH-)=10-5mol/L������ã�
Kb(NH3��H2O)=![]() =1.75��10-5��
=1.75��10-5��
��ˣ�������ȷ��Ϊ�����ȣ�1.75��10-5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L�����ܱ������г���X(g)��Y(g)��������ӦX(g)+Y(g) ![]() M(g)+N(g)������ʵ���������±�������˵������ȷ����
M(g)+N(g)������ʵ���������±�������˵������ȷ����
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(X) | n(Y) | n(M) | ||
�� | 700 | 0.10 | 0.10 | 0.09 |
�� | 800 | 0.20 | 0.20 | 0.10 |
�� | 900 | 0.10 | 0.15 | a |
A. ����ӦΪ���ȷ�Ӧ
B. ʵ����У���5minʱ���n(M)=0.05mol����0~5minʱ���ڣ���N��ʾ��ƽ����Ӧ����v��N��= 0.01mol/(Lmin)
C. ʵ����У��÷�Ӧ��ƽ�ⳣ��K=1.0
D. ʵ����У��ﵽƽ��ʱ��a����0.06
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 molL1CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH![]() CH3COO�� + H+�����ڸ�ƽ�⣬����������ȷ����
CH3COO�� + H+�����ڸ�ƽ�⣬����������ȷ����
A. ���ȣ�ƽ�����淴Ӧ�����ƶ�
B. ��������0.05 molL��1 H2SO4��Һ����Һ��c��H+������
C. ��������NaOH���壬ƽ��������Ӧ�����ƶ�
D. ��������ˮ��ˮ�ĵ���ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������12������Ϊ��ѧ��ѧ�г���������:
��Cu����NaCl����NaHSO4����SO3����H2SO4��C2H5OH����CaCO3����BaSO4����Cu(OH)2��Fe(OH)3��![]() NaOH��
NaOH��![]() NH3��H2O
NH3��H2O
��ش��������⣨����ţ���
��1�����ڵ���ʵ���_____��
��2�����ڷǵ���ʵ���_____��
��3����ˮ��Һ���ܵ���ĵ������_____��
��4������������ʵ���_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̸ɵ�صĸ�������Ϊ��ؿ���Ľ���п�������DZ��������̺�̼�۰�Χ��ʯī�缫����������Ȼ�п���Ȼ�淋ĺ�״��õ�طŵ�����в��� MnOOH���Ͼɵ���е�Zn��MnԪ�صĻ��գ��Ի�����������Ҫ�����塣
��. ����пԪ�أ��Ʊ�ZnCl2
����һ�����ȥ���弰ʯī�缫�ĺ�ɫ��״���м�ˮ�����裬����ܽ⣬�����˷���ù������Һ��
�������������Һ���õ�ZnCl2��xH2O���塣
����������SOCl2��ZnCl2��xH2O��������ȡ��ˮZnCl2��
��ȡ��ˮZnCl2������ʣ���SOCl2����֤�������к���SO2(�гּ�����װ����) ��װ�����£�
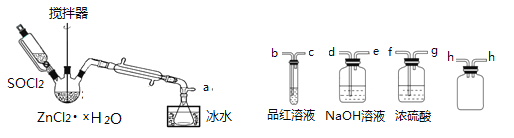
(��֪�� SOCl2��һ�ֳ��õ���ˮ�����۵㣭105�棬�е�79�棬140������ʱ�ֽ⣬��ˮ����ˮ�������������塣)
��1��д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ��______________________��
��2���ӿڵ�����˳��Ϊa��___��___�� h �� h ��___��___��___��e��______________
��. ������Ԫ�أ��Ʊ�MnO2
��3��ϴ�Ӳ���һ�õ��Ĺ��壬�жϹ���ϴ�Ӹɾ��ķ�����_________________________��
��4��ϴ�Ӻ�Ĺ��徭�������ɺ�������գ����յ�Ŀ��__________________________��
��. �������̴��ȵIJⶨ
��ȡ1.40g���պ�IJ�Ʒ������2.68g�����ƣ�Na2C2O4�����壬�ټ���������ϡ���Ტ���ȣ����ʲ����뷴Ӧ������ַ�Ӧ����ȴ����������Һת�Ƶ�100mL����ƿ��������ˮϡ�������ߣ�����ȡ��20.00mL����0.0200mol/L���������Һ���еζ����ζ����Σ����ĸ��������Һ�����ƽ��ֵΪ17.30mL��
��5��д��MnO2�ܽⷴӦ�����ӷ���__________________________________________��
��6����Ʒ�Ĵ���Ϊ______________________ ��
��7�������ղ���֣��ζ�ʱ���ĸ��������Һ���_____������ƫ�������� ƫС������ ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Ni2O3)��һ����Ҫ�ĵ���Ԫ�����Ϻ����ز��ϡ���ҵ�����ú�����ˮ(����Ҫ��NiR2�������ʽ����)��ȡ������(NiC2O4)���ٸ������ղ�������ȡ����������������������ͼ��ʾ��
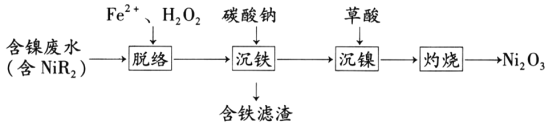
��֪����NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-Ϊ�л������壬K=1.6��10-14)
Ni2+(aq)+2R-(aq)(R-Ϊ�л������壬K=1.6��10-14)
��Ksp[Fe(OH)3]=2.16��10-39��Ksp[Ni(OH)2]=2��10-15
��Ka1(H2C2O4)= 5.6��10-2��Ka2(H2C2O4)= 5.4��10-5
�ܡ����硱�����У�R-���м���OH��Ӧ���ɡ�R(�л������ɻ�)����OH����H2O2������Ӧ���йط�Ӧ�ķ���ʽ���£�
i��Fe2++H2O2=Fe3++OH-+��OH
ii��R-+��OH = OH-+��R
iii��H2O2+2��OH=O2��+2H2O
��ش��������⣺
(1)�м���OH�ĵ���ʽ��________
(2)��������ʱ������Һ��c(Ni2+)=0.01mol��L-1������̼���Ƶ���Һ��pHΪ________(������Һ������䣬lg6��0.8)ʹFe3+ǡ�ó�����ȫ(���ӵ�Ũ�ȡ�1.0��10-5mol��L-1)����ʱ________(��С����ޡ�)Ni(OH)2�������ɡ�
(3)25��ʱ��pH=3�IJ�����Һ��c(C2O42-)/c(H2C2O4)________(������λ��Ч����)�������������õ������������������ӷ���ʽ��________
(4)�����ա������������Ļ�ѧ����ʽΪ_______________________________��
(5)����Fe2+��H2O2�ܹ�ʵ�֡����硱��ԭ����________��
(6)��������������Ũ���ᷴӦ����������д����Ӧ�����ӷ���ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС��������ͼ��ʾװ���Ʊ����ռ�Cl2��������������֤ʵ�飨�г�װ����ȥ��������˵����ȷ���ǣ� ��
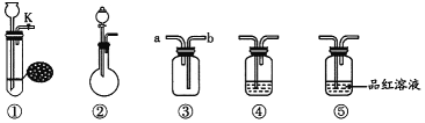
A. ��![]() ��Ũ�����Ʊ�
��Ũ�����Ʊ�![]() ʱ��ֻѡ
ʱ��ֻѡ![]()
B. ![]() ����
����![]() �ռ�ʱ��aΪ������
�ռ�ʱ��aΪ������
C. ![]() �м���NaBr��Һ��
�м���NaBr��Һ��![]() ��ͨ��
��ͨ��![]() ��Ӧ�������ã��²���Һ�ʳȺ�ɫ
��Ӧ�������ã��²���Һ�ʳȺ�ɫ
D. ![]() ��ͨ��
��ͨ��![]() ʹƷ����Һ��ɫ��ȡ����Һ���ȿɻָ���ɫ
ʹƷ����Һ��ɫ��ȡ����Һ���ȿɻָ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��̬��A�ڱ�״���µ��ܶ�Ϊ1.25 g��L��1��C�ܹ�����������Ӧ�� E��B��D���ܷ���������Ӧ���й����ʵ�ת����ϵ���£�

��ش�
(1) F�Ľṹ��ʽ______��
(2) A��B�ķ�Ӧ����______��
(3) C��D�Ļ�ѧ����ʽ______��
(4) ����˵������ȷ����______��
A����������Ͷ��B�У������Ƴ���ײ����������ķų�����
B��2 mol F���Է�Ӧ����1 mol��״����������ʽΪC4H6O5
C��G����NaHCO3��Һ�л��������
D��1 mol H�����뺬2 mol NaOH��ˮ��Һ��ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2(l)����MnO2�����º���MnO2�����·ֽ�������仯��ͼ��ʾ������˵����ȷ��
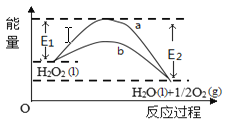
A. ��MnO2�����µķ�Ӧ������a����
B. a���߱�Ϊb���ߣ���Ӧ�Ļ���Ӱٷ�������
C. a���߱�Ϊb���ߣ�ƽ��ʱH2O2��ת��������
D. b���ߵ��Ȼ�ѧ����ʽΪ��H2O2(l) =H2O(l) +1/2O2(g) ��H= - ( E1 - E2)KJmol-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com