
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
分析 A.胶体的分散质微粒直径大小是胶体区别于其它分散系的本质特征所在;
B.丁达尔效应的是胶体特有的性质;
C.将饱和氯化铁溶液滴入沸水中制得氢氧化铁胶体;
D.氯化铁溶液、氢氧化铁胶体和氢氧化铁浊液,分散质分别为氯化铁、氢氧化铁和氢氧化铁,均为电解质.
解答 解:A.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,分散质粒子直径在1nm~100nm之间的分散系属于胶体,故A正确;
B.丁达尔效应的是胶体特有的性质,溶液和浊液无丁达尔效应,故B正确;
C.将饱和氯化铁溶液滴入沸水中制得氢氧化铁胶体,若将氯化铁溶液中加入氢氧化钠溶液,则得到的是氢氧化铁沉淀,故C错误;
D.氯化铁溶液、氢氧化铁胶体和氢氧化铁浊液,分散质分别为氯化铁、氢氧化铁和氢氧化铁,均为电解质,故D正确.
故选C.
点评 本题考查了物质分类方法,注意概念的理解应用,掌握基础是关键,题目较简单.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子的稳定性与分子间作用力的大小无关 | |
| B. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.2 | 0.6 |
| 1 | 0.9 | |
| 2 | 0.2 | |
| 4 | 0.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
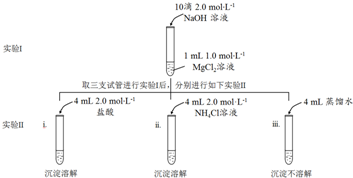
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com