
����Ŀ����ѧ��Ӧԭ�����о���ѧϰ��ѧ����Ҫ���ݡ��ش��������⣺
��1����֪������ȼ���ȡ�H����285.5kJmol��1������ˮ���Ȼ�ѧ����ʽΪ_____
��2����298K��101kPa�£�2SO2��g��+O2��g��2SO3��g����H����198kJmol��1������ͬ�����£�2mol SO2�� 1 mol O2��ַ�Ӧ�����շų�������_____198kJ������ڡ���С�ڻ��ڡ������÷�Ӧ��ƽ�ⳣ������ʽK��_____��
��3��25��ʱ���±�ΪһЩ���ܵ���ʵ�������ݣ�
���� | Fe��OH��2 | Cu��OH��2 | Fe��OH��3 |
��ʼ����ʱ��pH | 5.8 | 4.1 | 2.0 |
��ȫ����ʱ��pH | 8.3 | 6.4 | 3.2 |
�����£���ȥ����CuCl2��Һ�к��е�����FeCl2�����������Ϊ��
��Ӧ�ȼ���_____�����Լ����ƣ������������ӷ�Ӧ����ʽΪ_____
���ټ���CuO��������Һ��pH��_____��Χ�ڣ�ʹ��Һ�е�Fe3+ת��ΪFe��OH��3���������ˡ�
���𰸡�H2O(l)��H2(g)+![]() O2(g) ��H��+285.5 kJmol��1 С��
O2(g) ��H��+285.5 kJmol��1 С�� ![]() ˫��ˮ������ˮ�� H2O2+2Fe2++2H+��2Fe3++2H2O����Cl2+2Fe2+��2Fe3++2Cl���� 3.2��pH��4.1
˫��ˮ������ˮ�� H2O2+2Fe2++2H+��2Fe3++2H2O����Cl2+2Fe2+��2Fe3++2Cl���� 3.2��pH��4.1
��������
��1�����ø�˹������Ӧ�ȣ�
��2�����淴Ӧ���ص㡢�Լ��ͷ�Ӧ�ȵĹ�ϵ��
��3��pH��Ksp��Ӧ�á�
(1)������ȼ���ȵ��Ȼ�ѧ����ʽ��H2(g)+![]() O2(g)��H2O(l) ��H��-285.5 kJmol��1�����ݸ�˹���ɣ�����д��Һ̬ˮ�����Ȼ�ѧ����ʽ����ΪH2O(l)��H2(g)+
O2(g)��H2O(l) ��H��-285.5 kJmol��1�����ݸ�˹���ɣ�����д��Һ̬ˮ�����Ȼ�ѧ����ʽ����ΪH2O(l)��H2(g)+![]() O2(g) ��H��+285.5 kJ/mol����2�����淴Ӧ�����ܷ�Ӧ���ף�2molSO2��1molO2��ַ�Ӧ������ȫ����2molSO3�����Ȼ�ѧ����ʽ��ʾ������ȫ��Ӧ����2molSO3ʱ�ķ�Ӧ�ȣ����Է�Ӧ���շ��ȱ�198kJС�����ݷ���ʽ�Ϳ���д��ƽ�ⳣ������ʽ����ΪС��
O2(g) ��H��+285.5 kJ/mol����2�����淴Ӧ�����ܷ�Ӧ���ף�2molSO2��1molO2��ַ�Ӧ������ȫ����2molSO3�����Ȼ�ѧ����ʽ��ʾ������ȫ��Ӧ����2molSO3ʱ�ķ�Ӧ�ȣ����Է�Ӧ���շ��ȱ�198kJС�����ݷ���ʽ�Ϳ���д��ƽ�ⳣ������ʽ����ΪС�� ![]() ��
��
��3���ӱ��е����ݿ���֪������������������Fe(OH)2����ȥFe2+ ,��ΪFe(OH)2��Cu(OH)2��ʼ������pH����ɳ�����pH���ص��IJ��֣����Բ���ֱ�ӳ�ȥ Fe2+������Fe(OH)3��Cu(OH)2��ʼ������pH����ɳ�����pHû���ص��IJ��֣�Fe3+��ȫ������Cu2+��û�п�ʼ���������Կ��Խ�Fe2+ת��ΪFe3+,�Ա��ȥ��
����Fe2+ת��ΪFe3+,��Ҫ���������������Dz��������µ����ʣ�����ѡ��˫��ˮ����������Cl-,Ҳ����ʹ������������������ԭ�͵���غ���ƽ����ʽ����˫��ˮ���������� H2O2+2Fe2++2H+��2Fe3++2H2O����Cl2+2Fe2+��2Fe3++2Cl����
��Fe3+��Ҫ��ȫ������Cu2+û�п�ʼ����������pH�ķ�ΧΪ3.2��pH��4.1����Ϊ3.2��pH��4.1��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(PCl3)��һ�������л��ϳɵ���Ҫ������ʵ���ҳ��ú���������Cl2��ȡPCl3��װ����ͼ��ʾ��
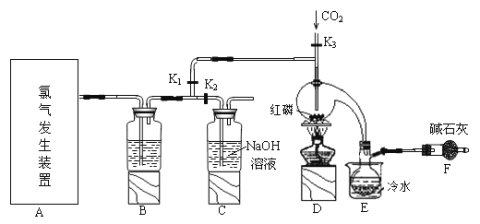
��֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��O2������POCl3(��������)�� POCl3����PCl3��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl��PCl3��POCl3���۷е���±���
���� | ��Է������� | �۵�/�� | �е�/�� |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
��ش��������⣺
��1�������ͼ��ѡ���Ʊ������ķ���װ��
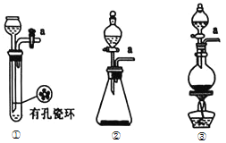
��ѡ�õ�װ����____������ţ�����Ӧ�����ӷ���ʽΪ____��
��2��B����ʢ�Լ���_____��
��3��E����ˮ��������____��
��4������F��������____��F�м�ʯ�ҵ�������___��
��5��ʵ���ƵõĴֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5����ͨ��__����������ƣ����ɵõ��ϴ�����PCl3��
��6��ͨ�����淽���ɲⶨ��Ʒ��PCl3������������
��Ѹ�ٳ�ȡ1.00g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.00mL�������м���10.00mL0.1000mol/L��ˮ(����)����ַ�Ӧ��
�����������Һ�м��뼸�ε�����Һ����0.1000 mol/L��Na2S2O3��Һ�ζ���
���ظ��ڡ��۲�����ƽ������0.1000 mol/LNa2S2O3��Һ8.00mL��
��֪��H3PO3+I2+H2O=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2S4O6�������������ݣ�����ⶨ������û��������Ӧ���ò�Ʒ��PCl3����������Ϊ___������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵʳ���к�Ca2+��Mg2+�����ʣ�ij����ⱥ��ʳ��ˮ��ȡNaOH��Һ�Ĺ���������ͼ��ʾ���ش��������⣺
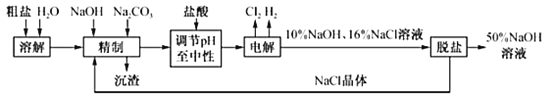
��1�������ơ������з�����Ӧ�����ӷ���ʽΪ_____
��2����������SO42������Ҳ�ϸߣ�������������_____������ĸ����Ҫ���Լ�Na2CO3֮_____���루�ǰ������
a��Ba��OH��2 b��Ba��NO3��2 c��BaCl2
��3���ڵ������У�����H2�ĵ缫����ӵ�Դ��_____����������ҺpH�����������_____�������������������������
��4���ռ�������ǵ�ⱥ��ʳ��ˮʱ���չ̶��ı���k�������ȣ����ɵIJ�Ʒ��������k��_____����д�������ʽ�ͽ���ҽ��������λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����(����)
A.���ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ�У�����Cl������ĿΪ NA
B.0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3 NA
C.��״���£�22.4LH2O���еķ�����ΪNA
D.һ��������2.3gNa��һ����������Ӧ����Na2O��Na2O2�Ļ���ת�Ƶĵ�����һ��Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ���ܽ��ȶ����ڵ��ȵ���������Cl2O��ClO2��Cl2O7�ȡ��й����ݼ�����
��ѧʽ | Cl2O | ClO2 | Cl2O7 |
�е�/�� | 3.8 | 11.0 | 82.0 |
��ش��������⣺
(1)���¡���ѹ�£������������������������__________��
(2)Cl2O7�����������������ˮ��Ӧ�����ӷ���ʽΪ__________��
(3)ClO2��һ�ֳ��õ����������ҹ���2000��������ClO2��������������ˮ����������������ˮʱ��ClO2���ɽ�ˮ�е�Fe2+��Mn2+��ת����Fe(OH)3��MnO2���������ȥ��˵��ClO2����__________�ԡ�
(4)��ҵ�Ͽ��������з�Ӧ�Ʊ�ClO2��2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4�����õ����ŷ���ʾ���÷�Ӧ����ת�Ƶķ������Ŀ______________��
(5)��ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2NaClO3+4HCl(Ũ)=2ClO2��+Cl2��+2H2O+2NaCl��
��Ũ�����ڷ�Ӧ����ʾ������������__________(�����)��
A����ԭ�� B�������� C������
����������Ӧ�в���0.1molClO2����ת�Ƶĵ�����Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������������������ԭ�������͵���
A. ʵ�������ű���ʳ��ˮ�ķ����ռ�����
B. ��ˮ��������ƽ��Br2+H2O![]() HBr+HBrO����������������Һ��AgBr�ǵ���ɫ����������Һ��ɫ��dz
HBr+HBrO����������������Һ��AgBr�ǵ���ɫ����������Һ��ɫ��dz
C. SO2��������SO3�Ĺ�����ʹ�ù���������������߶��������ת����
D. ���¡���ѹ�����£���2NO2![]() N2O4ƽ����ϵ�г���He����ϵ��ɫ��dz
N2O4ƽ����ϵ�г���He����ϵ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ճ���������;�dz��㷺���÷����ң���Al��Al2O3��Fe��Fe2O3��FeO �ȣ�Ϊԭ����ȡ�����Ĺ�����������ͼ���ش��������⣺

��֪��Fe3����ʼ������������ȫʱ��Һ��pH Ϊ1.9��3.7��
��1��������ˮ��ԭ����_______________________�������ӷ���ʽ��ʾ����
��2����������ʱ��Al2O3�ܽ�Ļ�ѧ����ʽΪ______________________��
��3����������ʱ��������Ӧ�����ӷ���ʽΪ_______________��
��4�������������Ŀ����______��������2������ϴ��ˮϴ����������գ��õ��IJ�Ʒ��������_____�����׳ƣ���
��5����������������IJ�����_________��__________�����˼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����O2��NH3�Ļ������448mLͨ�����ȵ�����������������������ַ�Ӧ����ͨ��������ˮ�������ռ���44.8mL O2��ԭ���������O2����������ǣ����谱ȫ��������������������ѻ���ɱ�״������ ��
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧ����2FeCl3+2KI===2FeCl2+2KCl+I2����2Fe+3Cl2![]() 2FeCl3����2KMnO4+16HCl(Ũ)===2KCl+2MnCl2+8H2O+5Cl2������ij��Һ����Fe2+��I��Cl��Ҫ������ȥI������ȥFe2+��Cl���ɼ�����Լ���
2FeCl3����2KMnO4+16HCl(Ũ)===2KCl+2MnCl2+8H2O+5Cl2������ij��Һ����Fe2+��I��Cl��Ҫ������ȥI������ȥFe2+��Cl���ɼ�����Լ���
A. Cl2B. KMnO4C. FeCl3D. HCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com