
 ;核外9个电子分别位于1s、2s、2p轨道,电子排布式为:1S22S22P5;最外层7个电子为价电子,价电子排布式为S22P5;依据电子层数等于周期数,最外层电子等于主族元素的族序数,9F位于第2周期VIIA族;
;核外9个电子分别位于1s、2s、2p轨道,电子排布式为:1S22S22P5;最外层7个电子为价电子,价电子排布式为S22P5;依据电子层数等于周期数,最外层电子等于主族元素的族序数,9F位于第2周期VIIA族; ;核外25个电子分别位于1s、2s、2p、3s、3p、3d、4s轨道,电子排布式为:[Ar]3d54S2,价电子有7个分别位于3d、4S两个轨道上,价电子排布式为3d54S2,周期序数等于电子层数,价电子数等于副族族序数,所以25Mn位于第4周期VIIB族;
;核外25个电子分别位于1s、2s、2p、3s、3p、3d、4s轨道,电子排布式为:[Ar]3d54S2,价电子有7个分别位于3d、4S两个轨道上,价电子排布式为3d54S2,周期序数等于电子层数,价电子数等于副族族序数,所以25Mn位于第4周期VIIB族; 、1S22S22P5、2S22P5、第2周期VIIA族;
、1S22S22P5、2S22P5、第2周期VIIA族; 、[Ar]3d54S2、3d54S2、第4周期VIIB族.
、[Ar]3d54S2、3d54S2、第4周期VIIB族.


科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| (1) | 将固体混合物溶于水,搅拌 | 溶液无色透明 |
| (2) | 向此溶液中滴加BaCl2溶液 | 出现白色沉淀 |
| (3) | 过滤,将沉淀物置于足量稀硝酸中 | 沉淀完全溶解,有气泡产生 |
| (4) | 向滤液中加入AgNO3和稀硝酸 | 有白色沉淀产生 |
| A、固体混合物中肯定有KCl |
| B、固体混合物中可能含有Na2SO4 |
| C、(2)中发生的离子反应为:Ba2++CO32-=BaCO3;Ba2++SO42-=BaSO4 |
| D、固体混合物中肯定含有Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
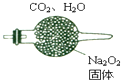 某无色溶液中只含有下列离子中的某几种:Na+、Mg2+、SO42-、CO32-、Cl-、MnO4-.为了鉴别这些离子,分别取少量溶液进行以下实验:
某无色溶液中只含有下列离子中的某几种:Na+、Mg2+、SO42-、CO32-、Cl-、MnO4-.为了鉴别这些离子,分别取少量溶液进行以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com