
����Ŀ��Ϊ̽����ϩ����ļӳɷ�Ӧ����ͬѧ��Ʋ�����������ʵ�飺�����Ҵ���Ũ����Ϊԭ����ȡ��ϩ�������ɵ�����ֱ��ͨ����ˮ�У�������Һ��ɫ����֤����ϩ����ˮ�����˼ӳɷ�Ӧ����ͬѧ�����ڼ�ͬѧ��ʵ���У������������д̼�����ζ���Ʋ����Ƶõ���ϩ�л����ܺ�������Ũ����Ļ�ԭ�������壬�ɴ�����������ȳ�ȥ֮��������ˮ��Ӧ������ش��������⣺
��l����ͬѧ�Ʋ����ϩ�бض����е�һ���������壬������ˮ��Ӧ�Ļ�ѧ����ʽ��_______������֤�����б���ȫ����ȥ��Ϊ����ͬѧ�������ͼ��ʾ��ʵ��װ�á���ش�
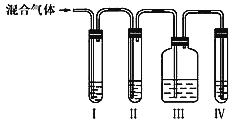
�� I����װ�ÿ�ʢ�ŵ��Լ���I______����______����______����______����ѡ����ţ���
A.Ʒ����Һ B. NaOH��Һ C��Ũ���� D.����KMnO4��Һ
�� ����Ƶ�ʵ������ȷ����������ϩ��������_____________��
��2��Ϊ��֤��ϩ����ķ�Ӧ�Ǽӳɷ�Ӧ������ȡ����Ӧ����ͬѧ����ɽ������ҳ��Ӻ������ͨ����ˮ�У���pH��ֽ�ⷴӦ����Һ������ԣ�����Ϊ�Ƿ����______�������������������������___________________��
��3�������У����˶�Ա������˻�Ť��ʱ����ҽ�漴����Ա�����˲�λ����ҩ�������飨�е�12.27�棩�����оֲ��䶳����Ӧ��������Ҫ�õ��ϴ�����������Ӧ���õ���ȡ������[�û�ѧ��Ӧ����ʽ���л����ýṹ��ʽ��ʾ��]___________���÷�Ӧ��������______��Ӧ�������������������䶳����Ӧ�������ľ�������______________��
���𰸡� SO2 +Br2 + 2H2O = H2SO4+2HBr A B A D III ��Ʒ����Һ����ɫ�� IV�����Ը��������Һ��ɫ�� ���� ������ȡ����Ӧ�������� HBr��ʹ��Һ���Գ����ԡ� CH2=CH2+HCl�� CH3CH2Cl �ӳɷ�Ӧ �е�ͣ�����������
�����������⿼��ʵ�鷽����������ۣ���1����ΪŨ���������ˮ�ԣ����Ҵ�̼����Ȼ������Ũ����������ԣ���̼������ӦC��2H2SO4=CO2����2SO2����H2O��SO2��ʹ��ˮ��ɫ������SO2��Br2��2H2O=H2SO4��2HBr������֤SO2�Ĵ��ڣ�һ����Ʒ����Һ��Ʒ����Һ��ɫ��˵������SO2����ΪSO2�������������NaOH��Һ��ȥ��Ȼ������Ʒ����Һ��֤SO2�Ƿ���������ͨ����������Һ�У���������Լ���˳����A��B��A��D����������III ��Ʒ����Һ����ɫ�� IV�����Ը��������Һ��ɫ����2���������ȡ����Ӧ������HBr��HBr��ˮ��Һ�����ԣ��ӳɷ�Ӧֻ����CH2Br��CH2Br����˱�ͬѧ������Ǻ����ģ���3����ȡ���������飬�������������������ȡ����Ӧ����Ϊ���������������ʽ϶࣬Ӧ��CH2=CH2��HCl�����ӳɷ�Ӧ����Ӧ����ʽΪCH2=CH2��HCl��CH3CH2Cl��������ķе���12.27�棬�е�ϵͣ�Һ��ת�������壬��Ҫ�����������������˴ﵽ�䶳������Ч����


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2molij�л����0.5mol������һ�ܱ�������ȼ�յò���ΪCO2��CO��H2O(��)����������ͨ��Ũ����ʱ��Ũ���������������10.8g����ͨ�����ȵ�����ͭʱ������ͭ������������3.2g����ͨ����ʯ��ʱ����ʯ�ҵ�����������17.6g�����л���Ļ�ѧʽ��( )
A��C2H4 B��C2H6O C��C2H6O2 D��C3H6O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��������뽺���ص���
A���峿�������п���һ���ƵĹ���
B�����м��������ʹ�����ʵȾ۳����ƳɿɿڵĶ���
C��FeCl3��Һ����NaOH��Һ�������ɫ����
D�����õ�Ӿ�����ᡢ�齺���������ȵس����ڶƼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A�����ۻ�״̬���ܵ���Ļ�����һ�������Ӿ���
B�����Ӿ����״̬�仯ֻ��˷����Ӽ�������
C���������ı����ǽ������������ɵ��Ӽ�������
D��ԭ�Ӿ�����ֻ���ڷǼ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʷ��ÿһ���ش��ֶ�������ƽ��˿�ѧ�ķ�չ��������ѧ���Ž��з�Ի�ѧ��ͻ���������ڣ� ��
A.�����Ԫ��������
B.�����˺ϳɰ�����������
C.��ʾ��ȼ�յı���
D.��ȡ����űҩ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����KMnO4��Һ�ȿɽ����顢��ϩ�����ֿ����ڳ�ȥ�����е���ϩ
B. ������ˮ���𱽺�������
C. ����������ֻ�е���
D. ���顢��ϩ�������壬��ȫȼ��ʱ������������ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��A��B��D��E��G��ԭ������������������A��Gͬ���壬 B��D��Eͬ���ڡ�A�ֱ���B��E��G�γ�ԭ�Ӹ�����Ϊ1:1�Ļ�����ס��ҡ����������� ���³�ѹ�·ֱ�Ϊ���塢Һ�塢���壬��ȼ��ʱ���������Ҳ���Ũ�ҵĺ��̣���Ϊ���Ӿ��塣
(1)D�Ļ�̬ԭ����______��δ�ɶԵ��ӣ��ĵ���ʽΪ____________
(2)����ˮ���ҷ�Ӧ����ǿ��X��A�ĵ��ʣ��仯ѧ����ʽΪ______��
(3)�ҵ�ˮ��Һ�������ԣ�����ˮ�еĵ��뷽��ʽΪ______��
(4)B��E����Ԫ�ذ�ԭ�Ӹ�����1:2�γɻ�����Y����X��Y�����ʵ���֮��Ϊ2:1 ��ȫ��Ӧ��������ҺŨ��Ϊ0.1 mol/L,���и�����Ũ�ȴӴ�С��˳������Ϊ______��
(5)��25��C��10lkPaʱ��16.0gҺ̬D2A4����������ȫȼ�շų�����312 kJ�������� ������Ⱦ���ʣ�����һ��Ϊ���ʣ���һ���������д���÷�Ӧ���Ȼ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ����H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ������һЩ��ѧ���ļ��ܣ����ݼ������ݹ��㷴ӦCH4��g��+4F2��g��=CF4��g��+4HF��g���ķ�Ӧ����HΪ����������
��ѧ�� | C��H | C��F | H��F | F��F |
����/��kJmol��1�� | 414 | 489 | 565 | 155 |
A. +485 kJmol��1 B. ��485 kJmol��1
C. +1940 kJmol��1 D. ��1940 kJmol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com