
分析 根据导电原因、电解质、化合物的定义判断,能导电的物质必须含有自由电子或自由离子,非金属石墨、金属单质和在熔融状态下的电解质以及其溶液都能导电;
电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物,非金属氧化物、大多数的有机物(如蔗糖、乙醇等);
单质,混合物既不是电解质也不是非电解质.
解答 解:①石墨是非金属单质,能导电;但它既不是电解质也不是非电解质;
②三氧化硫在常温下为气体,不能导电;在水溶液中与水反应生成亚硫酸酸,亚硫酸酸电离出自由移动的离子导电,三氧化硫自身不能电离,三氧化硫是非电解质;
③液态氯化氢,只存在氯化氢分子,不能导电;但在水溶液中能完全电离出自由移动的阴阳离子而使其导电,所以液态氯化氢是强电解质;
④氯气是单质,因没有自由电子或自由离子,所以不导电;它既不是电解质也不是非电解质;
⑤熔融的硫酸钾中有自由移动的离子,所以能导电,硫酸钾在水溶液中能完全电离出自由移动的阴阳离子而使其导电,所以熔融的硫酸钾是强电解质;
⑥食盐晶体中没有自由移动的离子,所以不能导电,食盐在水溶液中能完全电离出自由移动的阴阳离子而使其导电,所以食盐是强电解质;
⑦硫酸溶液是硫酸的水溶液,水溶液中有自由移动的硫酸根离子和氢离子能导电;硫酸溶液是混合物,既不是电解质也不是非电解质;
⑧乙醇只存在乙醇分子,不导电;乙醇是化合物,其水溶液只以乙醇分子存在,不导电,乙醇属于非电解质;
⑨冰醋酸为醋酸(CH3COOH)的固态形式,只有乙酸分子,不能导电;但在水溶液中能部分电离出自由移动的阴阳离子而使其导电,所以冰醋酸是弱电解质;
⑩一水合氨是化合物,无自由移动的离子不导电;但在水溶液中,NH3•H2O?NH4++OH-,属于弱电解质;
故答案为:①⑤⑦;③⑤⑥;⑨⑩;②⑧.
点评 本题考查了强弱电解质的判断,导电的原理等知识,明确电解质的相关概念、正确区分强弱电解质是解本题关键,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题

| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| (2) | 乙炔 | A→C→E | CaC2+2H2O→CH≡CH↑+Ca(OH)2 |
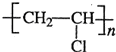 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构简式为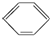 ,有三个双键,可与溴水发生加成反应 ,有三个双键,可与溴水发生加成反应 | |
| C. | 苯的6个碳原子和6个氢原子在同一平面内 | |
| D. | 将1mL苯和1mL水充分混合后静置,二者互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;写出C2B2的电子式
;写出C2B2的电子式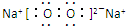 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极反应式为:2MnO2+H2O+2e-═Mn2O3+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 电池工作时,电解质溶液中OH?的物质的量近似不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可以生成2 mol NH 3 | |
| B. | 单位时间内,若消耗了0.5mol N2的同时,生成1 mol NH3,则反应达到平衡 | |
| C. | 反应达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2 | |
| D. | 反应达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
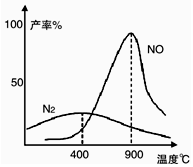 肼和氧气在相同催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
肼和氧气在相同催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:| A. | v(N2)=v(NO) | |
| B. | 反应①的△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去甲苯中的苯甲酸,可以先加入NaOH溶液,充分振荡,然后分液 | |
| B. | 除去C2H5OH中的少量CH3COOH:加足量CaO,蒸馏 | |
| C. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO | |
| D. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸将乙酸全部转化为乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com