
| ||
| 0.2mol |
| 2 |
| 0.2mol |
| 2 |


科目:高中化学 来源: 题型:
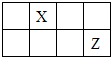 短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法正确的是( )
短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法正确的是( )| A、原子半径:r(Y)>r(Z)>r(W) |
| B、Y、Z、W的简单离子的电子层结构相同 |
| C、XWm与YWn中化学键类型相同(m、n为正整数) |
| D、元素Z的简单气态氢化物的热稳定性比W的简单气态氢化物强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究碳的化合物具有重要意义.
运用化学反应原理研究碳的化合物具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| △ |
| 250~350℃ |
| 铜粉 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.
有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
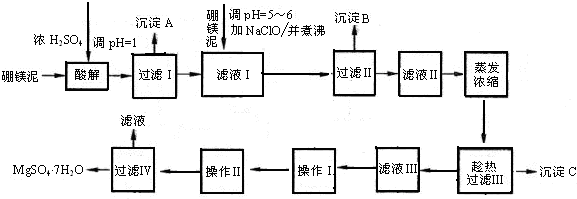
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“地沟油”禁止食用,但可以用作化工原料 |
| B、从自然界中提取元素的单质都必须通过化学反应才能实现 |
| C、为了增加食物的营养成分,可以大量使用食品添加剂 |
| D、可以在奶粉中添加三聚氰胺以提高氮的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com