
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的 HCN 气体,同时 HCN 又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
下列选项错误的是( )
A.向NaCN溶液中通入少量CO2发生的离子反应为2CN-+H2O+CO2=2HCN+![]()
B.相同浓度的 HCOOH和NaCN 的溶液中,水的电离程度前者小
C.中和等体积、等pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者
D.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者大于后者
【答案】A
【解析】
A.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2=HCN+HCO3-反应,故A错误;
B. 相同浓度的 HCOOH和NaCN 的溶液中,前者是酸,抑制水电离,NaCN后者为弱碱盐,水解,促进水电离,水的电离程度前者小,故B正确;
C. 等pH的HCOOH和HCN溶液,甲酸的物质的量浓度小于氢氰酸,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数大,故D正确;
故选A。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬![]() 和
和![]() 废水常用方法,过程如下:CrO42-
废水常用方法,过程如下:CrO42-![]()
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3 ,已知废水中Cr的含量为
Cr(OH)3 ,已知废水中Cr的含量为![]() ,当溶液中离子浓度小于
,当溶液中离子浓度小于![]() 时认为离子已经沉淀完全,常温下,
时认为离子已经沉淀完全,常温下,![]() 有关叙述中不正确的是
有关叙述中不正确的是
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为:![]()
C.处理含铬废水可使用强碱![]() ,也可以使用弱碱氨水
,也可以使用弱碱氨水
D.当![]() 时,废水中铬元素沉淀完全
时,废水中铬元素沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2 ![]() N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸![]() 溶液与酸性
溶液与酸性![]() 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
(查阅资料)![]() 溶液氧化
溶液氧化![]() 的反应历程为:
的反应历程为:
![]()
(提出假设)假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______。
(设计、完成实验)
![]() 称取______g草酸晶体
称取______g草酸晶体![]() ,配置500mL
,配置500mL![]()
![]() 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______。
②下列操作会使所配溶液浓度偏低的是______![]() 填下列选项的字母序号
填下列选项的字母序号![]() 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
![]() 完成探究,记录数据
完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间
| |||
| 等浓度
|
|
稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量 |
|
4 | 30 | 20 | x | 20 | 加入5mL
| 18 |
则![]() ______,假设______成立。
______,假设______成立。
![]() 由于
由于![]() 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取![]()
![]()
![]() 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL![]() 稀硫酸,用
稀硫酸,用![]() 中
中![]() 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗![]() 溶液
溶液![]() ,则草酸溶液与酸性
,则草酸溶液与酸性![]() 溶液反应的离子方程式为:______,上述实验中
溶液反应的离子方程式为:______,上述实验中![]() 溶液的物质的量浓度为______。
溶液的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/LNa2CO3的溶液中:c(![]() )=2c(H2CO3)+c(H+)- c(OH-)
)=2c(H2CO3)+c(H+)- c(OH-)
B.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(![]() )+2c(
)+2c(![]() )+2c(H2CO3)
)+2c(H2CO3)
C.向3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.等物质的量的CH3COOH、CH3COONa混合溶液pH=4.75中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋![]() 主要成分是
主要成分是![]() 的总酸量
的总酸量![]() 。已知
。已知![]() 终点时所得溶液呈碱性。
终点时所得溶液呈碱性。
Ⅰ、实验步骤:
(1)用移液管量取![]() 食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中。
于锥形瓶中。
(3)滴加2滴_____________作指示剂。
(4)读取盛装![]() 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。

(5)滴定,当______________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。Ⅱ![]() 实验记录
实验记录

Ⅲ、数据处理与讨论:
(1)根据上述数据分析得![]() 市售白醋
市售白醋![]() ________
________![]() 。
。
(2)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______![]() 填写序号
填写序号![]() 。
。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
E. 滴定终点读数时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)铅蓄电池的负极材料为________________________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的___________倍。(保留三位有效数字)
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是____________ (任写一条)。
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(![]() )=_____________ mol·L-1。
)=_____________ mol·L-1。
(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+![]() (aq)=PbCO3(s)+
(aq)=PbCO3(s)+![]() (aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在__________极生成(填“阴”或“阳”);而另一极存在电极反应Pb2++2e-=Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
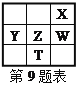
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①、②、③、④四种元素的基态原子的电子排布式如下:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() 。则下列有关比较中不正确的是
。则下列有关比较中不正确的是
A.电负性:④>③>②>①
B.最高正化合价:③>②>①>④
C.原子半径:①>②>③>④
D.第一电离能:④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com