
| A. | Ag+ | B. | H+ | C. | SO42ˉ | D. | OHˉ |
分析 A.银离子与氯离子反应生成氯化银沉淀;
B.氢离子不与题干中四种离子反应;
C.硫酸根离子与钡离子反应生成硫酸钡沉淀;
D.氢氧根离子与铵根离子反应生成弱电解质一水合氨.
解答 解:A.Ag+、Cl-之间反应生成难溶物氯化银,在溶液中不能大量共存,故A错误;
B.H+不反应NH4+、Ba2+、NO3-、Cl-,在溶液中能够大量共存,故B正确;
C.SO42-、Ba2+之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故C错误;
D.NH4+、OH-之间反应生成一水合氨,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确常见的离子不能共存的情况,如:发生复分解反应、发生氧化还原反应等,试题培养了学生灵活应用基础知识的能力.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| B. | 逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都不变,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都减慢,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开化学键的过程会放出能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应中,反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
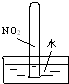 |  |  |  |
| ① | ② | ③ | ④ |
| A. | 实验①试管最终会充满水 | |
| B. | 实验②试管中溶液变为血红色 | |
| C. | 实验③试管中出现砖红色沉淀 | |
| D. | 实验④CuSO4溶液中会形成一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
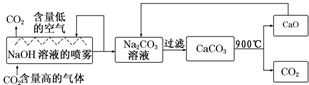
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
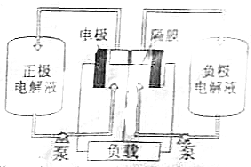 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com