
(1)用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,实验时应选用仪器的先后顺序是(填入编号):_________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号)_____▲___。
A、使用容量瓶前检查它是否漏水
B、容量瓶用蒸馏水洗净后,再用待配溶液润洗
C、配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D、配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
E、盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F、往容量瓶中转移溶液时应用玻璃棒引流
(3用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸时,下列操作会引起实验结果偏高的是:____▲
A、溶解时烧杯中的溶液没有冷却就转移到容量瓶中。
B、将烧杯中的溶液转移到容量瓶后洗涤烧杯但未将洗涤液转移到容量瓶中。
C、定容时俯视容量瓶的刻度线。
D、定容时仰视容量瓶的刻度线。
E、用量筒量取一定体积的浓硫酸时,仰视读数。
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
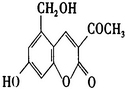
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:







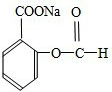


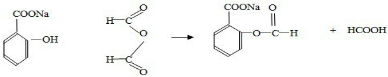

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
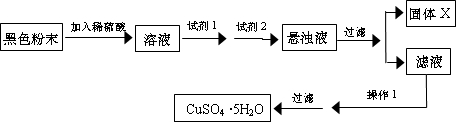
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com