
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- |
分析 A.二者反应生成硫酸钡和水;
B.碳酸钙为沉淀,保留化学式;
C.次氯酸为弱酸,保留化学式;
D.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主.
解答 解:A.稀硫酸与氢氧化钡溶液反应,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A正确;
B.将大理石投入到足量盐酸中,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故B错误;
C.将Cl2与水反应,离子方程式:Cl2+H2O═H++Cl-+HClO,故C错误;
D.碳酸钠溶液显碱性是因为碳酸根离子水解缘故,离子方程式:CO32-+H2O?HCO3-+OH-,故D正确;
故选:AD.
点评 本题考查了离子方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应离子方程式书写,注意化学式拆分,题目难度不大.


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 60g SiO2中含有NA个SiO2分子 | |
| B. | 标况下,22.4L SO3的分子数为NA | |
| C. | 1L 0.5 mol•L-1 CuCl2溶液中含有0.5NA个Cu2+ | |
| D. | 15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是相邻原子间的相互作用 | |
| B. | 化学键既存在于相邻原子之间,又存在与相邻分子之间 | |
| C. | 化学键通常指的是相邻的两个或多个原子之间的强烈互吸引作用 | |
| D. | 化学键通常是指物质中相邻的原子或离子之间存在的强烈相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应::Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2SO4(或HNO3、H2CO3) | ③NaOH(或KOH) ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO4(或K2CO3、Na2SO3) | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①④⑥ | C. | ①②④⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
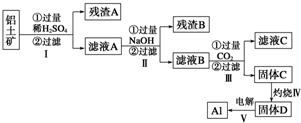
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- | |
| C. | 澄清透明溶液中:K+、Fe3+、HCO3-、AlO2- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 玻璃仪器 |
| A | 分离苯和NaOH溶液 | 分液漏斗、烧杯 |
| B | 用直接蒸馏的方法分离乙醇和乙酸 | 蒸馏烧瓶、冷凝管、锥形瓶 |
| C | 配制100mL pH=1的CH3COOH溶液 | 1 00mL容量瓶、胶头滴管、烧杯、玻璃棒、量筒 |
| D | 利用MnO2和浓盐酸制备并收集Cl2 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com