
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H20 |
分析 A.Ba(OH)2溶液中滴加NaHSO4溶液至中性,反应生成硫酸钡、硫酸钠和水;
B.胶体不是沉淀,不能标注沉淀符号;
C.电荷不守恒;
D.澄清石灰水中氢氧化钙应拆成离子形式.
解答 解:A.Ba(OH)2溶液中滴加NaHSO4溶液至中性,反应生成硫酸钡、硫酸钠和水,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A正确;
B.用氯化铁溶液和沸水反应制取氢氧化铁胶体,离子方程式:Fe3++3H2O(沸水)═Fe(OH)3+3H+,故B错误;
C.钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.澄清石灰水与稀盐酸反应:OH-+H+=H20,故D错误;
故选A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分及电荷守恒规律,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:选择题
| A. | K+MnO4- Cl- SO42- | B. | Na+K+NH4+Ba2+ | ||
| C. | Na+HCO3- NO3- SO42- | D. | Na+SO42- S2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度的NH3•H2O时得到的滴定曲线.
水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度的NH3•H2O时得到的滴定曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
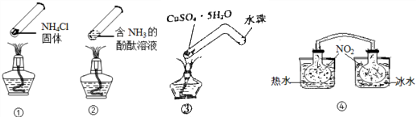
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl易升华 | |
| B. | 加热时,②溶液颜色变,冷却后又恢复为原来的颜色 | |
| C. | 加热时,③中固体由蓝色变为白色,冷却后又恢复为原来的颜色 | |
| D. | ④中,浸泡在热水中的容器内气体颜色变深,说明受热时反应2NO2?N2O4向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 常温常压下,1.06gNaCO3含有的分子数目为0.02NA | |
| D. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com