

| 25℃平衡体系(苯、水、HA) | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA H++A- H++A- | K1 | △H1 | 3.0×10-3 mol·L-1 |
在苯中,2HA (HA)2 (HA)2 | K2 | △H2 | 4.0×10-3 mol·L-1 |
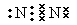
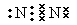 。
。

科目:高中化学 来源:不详 题型:单选题
 Cd)含量超标约80倍,长达100-公里的河水受到严重污染,用于降污的主要药品是聚氯化铝[Al2(OH)nCl(6-n)]m],聚氯化铝不像硫酸铝那样有固定的分子式,下列说法不正确的是
Cd)含量超标约80倍,长达100-公里的河水受到严重污染,用于降污的主要药品是聚氯化铝[Al2(OH)nCl(6-n)]m],聚氯化铝不像硫酸铝那样有固定的分子式,下列说法不正确的是A.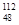 Cd原子的中子数为64 Cd原子的中子数为64 | B.聚氯化铝能降污是因为它有强氧化性 |
| C.聚氯化铝是混合物 | D.镉的单质有导电性和延展性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.R为第ⅣA族元素 | B.R的气态氢化物为HR |
| C.R有可能形成含氧酸H2RO4 | D.R的气态氢化物水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:F<Mg<K | B.稳定性:PH3>H2S>NH3 |
| C.酸性:H3PO4<H2SO4<HClO4 | D.碱性:Al(OH)3<Mg(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
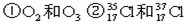 ③H2O和 D2O
③H2O和 D2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com