
(1)乙醇、水与钠反应的现象分别是________________________________________________________________________________;
其反应方程式分别是________________________________________________________________________________________________________________________________________________。
(2)乙醇在空气中燃烧的现象为________________________________________________________________________;
其反应方程式为________________________________________________________________________。
(3)乙醇催化氧化的化学方程式为________________________________________________________________________________________________________________________________________________。
科目:高中化学 来源: 题型:
在4℃时,100 mL水中溶解了 22.4 L HCl气体(标准状况下测得)后形成溶液。下列说法正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
查看答案和解析>>
科目:高中化学 来源: 题型:
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质
LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成 LiMnO2。回答下列问题:
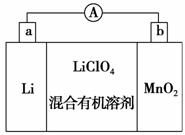
(1)外电路的电流方向是由________极流向________极。
(填字母)
(2)电池正极反应式为_____________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是______________________________________________________。
(4)MnO2 可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为___________________________________________________________。
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.乙醇分子可以看作是乙烷分子中的一个氢原子被—OH取代而形成的
B.乙醇分子中的氢原子都可以被钠置换
C.—OH和OH-两种微粒中质子数、电子数都相等
D.水和乙醇分子中的羟基化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①C(s)+1/2O2(g)===CO(g) ΔH1=-110.35 kJ·mol-1
②CO(g)+1/2O2(g)===CO2(g) ΔH2=-282.57 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH3
则ΔH3等于( )
A.+172.22 kJ·mol-1 B.-172.22 kJ·mol-1
C.+392.92 kJ·mol-1 D.-392.92 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于粒子结构的描述不正确的是 ( )。
A.H2S 和 NH3 均是价电子总数为8的极性分子
B.HS -和 HCl 均是含一个极性键的 18 电子粒子
C.CH2Cl2 和 CCl4 均是四面体构型的非极性分子
D.NCl3 是含极性键的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
为省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液(直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器用品)以巧妙的构思“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是___________________________________________________
________________________________________________________________________。
甲同学的设计思路是__________________________________________________
________________________________________________________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是________________________________________________________________________
________________________________________________________________________。
乙同学判断出锌、铜金属活动性相对强弱,所依据的原理是
________________________________________________________________________
________________________________________________________________________。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂(作为电解液),反应在调控下随即开始,实验中有关的化学反应方程式为________________________________________________________________________
________________________________________________________________________。
获得的实验明显现象是_______________________________________________
________________________________________________________________________。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌和铜的金属活动性的相对强弱(简要说明操作和现象)________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com