
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
分析 A.草酸氢钠溶液显酸性,说明HC2O4-的电离程度大于其水解程度,但电离程度不大,且存在水的电离;
B.V(NaOH)=5 mL时,溶液中的溶质是NaHC2O4和Na2C2O4,且二者浓度相等,结合物料守恒判断;
C.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,结合物料守恒判断;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4.
解答 解:A.草酸氢钠溶液显酸性,说明HC2O4-的电离程度大于其水解程度,但电离程度不大,且水电离会产生氢离子,则V(NaOH)=0时,c(Na+)>c(HC2O4- )>c(H+)>c(C2O42-)>c(OH-),故A错误;
B.当V(NaOH)=5时,溶液中的溶质是NaHC2O4和Na2C2O4,且二者浓度相等,根据Na、C原子数目关系(物料守恒)可知:2c(Na+)═3c(C2O42-)+3c(HC2O4- )+3c(H2C2O4),故B错误;
C.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,结合物料守恒:c(Na+)═2c(HC2O4-)+2c(C2O42-)+32c(H2C2O4),故C错误;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>c(C2O42-)>c(HC2O4- ),故D正确;
故选D.
点评 本题考查溶液中离子浓度大小,明确溶液中的溶质是解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金刚石>晶体硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA | |
| B. | 1.5 mol NO2与足量水反应,转移的电子数为1.5 NA | |
| C. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| D. | 常温常压下,11.2 L Cl2含氯原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
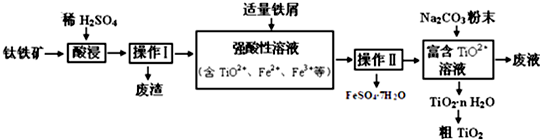
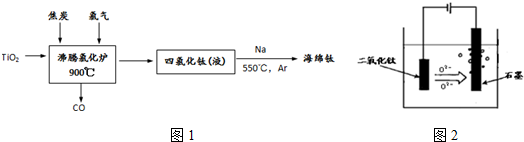
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度过高对合成氨不利 | |
| B. | 合成氨在高压下进行是有利的 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 增加N2的浓度可提高平衡混合物中NH3的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com