
| A. | 溴乙烷 | B. | 天然气 | C. | 石油 | D. | 酒精 |
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | 在船底镶嵌锌块和将船体与电源负极相连,二者防腐的方法都称为牺牲阳极的阴极保护法 | |
| C. | 1 mol葡萄糖水解能生成2mol CH3CH2OH和2mol CO2 | |
| D. | 不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
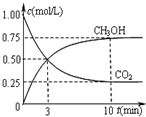 工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.
工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
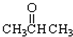 ③CH3CH2Br ④
③CH3CH2Br ④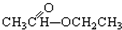 ⑤
⑤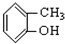 ⑥
⑥ ⑦
⑦ ⑧
⑧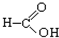 ⑨
⑨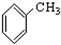 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
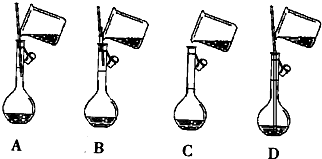
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
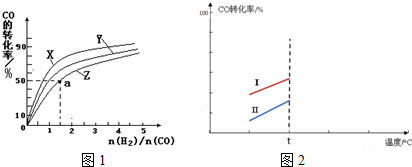
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤 | |
| B. | 定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切 | |
| C. | 洗涤量筒,并将洗涤液转入容量瓶 | |
| D. | 定容时仰视读数. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com