
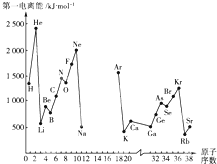
 根据信息回答列问题:
根据信息回答列问题:| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
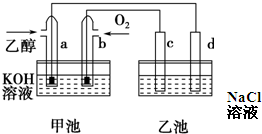
| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比是2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、NF3在潮湿的空气中泄漏会产生红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比为2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、按照树状分类法的分类原则,NF3属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com