
分析 一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,不同非金属形成极性键,同种非金属形成非极性键,以此来解答.
解答 解:①O2 中只含非极性键;
②Na2O2中含离子键和O-O非极性键;
③NaOH含离子键和O-H极性键;
④CO2只含C、O之间的极性键;
⑤H2O2中含O-H极性键和O-O非极性键;
⑥CaCl2中只含离子键;
⑦NH4Cl中含离子键和N-H极性键,则
(1)含有离子键构成的物质是②③⑥⑦,故答案为:②③⑥⑦;
(2)只由非极性键构成的物质是①,故答案为:①;
(3)由极性键和非极性键构成的物质是⑤,故答案为:⑤;
(4)由离子键和极性键构成的物质是③,故答案为:;
(5)由离子键和非极性键构成的物质是②,故答案为:②.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
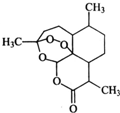 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 有“-O-”键,分子式C15H22O5,可发生取代反应 | |
| B. | 有“六元环”结构,是苯的同系物,可发生加成反应 | |
| C. | 有“-O-O-”键,氧化性较强,可发生还原反应 | |
| D. | 有“-COOC-”键,碱性条件下,可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | CO32-VSEPR模型名称与离子的立体构型名称不一致 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaCl溶液中Cl-的数目为0.1NA | |
| B. | 16g O2和O3的混合气体中所含的氧原子数为NA | |
| C. | 22.4L H2中含有的氢原子数一定为2NA | |
| D. | 1mol Cl2与过量的金属钠充分反应后,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 苯甲酸 | 1.2659 | 122.13 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有 机溶剂 |
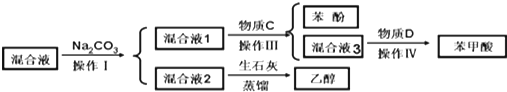
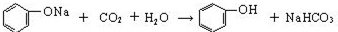 .
.| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加BaCl2, 振荡,静置 | 产生白色沉淀,BaCO3 |
| ②取少量步骤①上层清夜于试管,滴加0.1mol/L盐酸再将产生的气体通入澄清石灰水中 | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加0.1mol/L FeCl3溶液,振荡 | 溶液不显紫色, 说明混合液1不含有酚羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:C>B>A | B. | 离子半径:Bn-<An+ | ||
| C. | C是稀有气体元素的原子 | D. | 原子半径:A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
, +CO2+H2O→
+CO2+H2O→ +NaHCO3,
+NaHCO3, +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
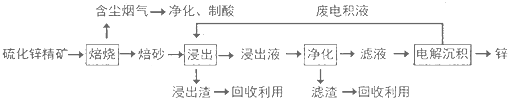
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com