
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:2016届福建省高三上学期10月第一次月考化学试卷(解析版) 题型:选择题
将钠、铝、铁各1mol分别投入到等体积且同浓度的盐酸中,产生的氢气体积在相同条件下
A、钠可能最多 B、铝铁不可能一样多
C、铝一定最多 D、无法判断
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
(14分)铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石的混合物。某化学兴趣小组从铁砂中分离出磁性氧化物,并进行铝热反应实验。
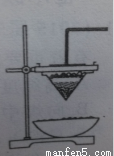 (1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是_________________现象很壮观,取少许生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现结果的原因,除了可能混有没有反应的磁性氧化铁外,还有一个原因是____________设计一个简单的实验方案,证明上述所得“铁块”中含有金属铝。该实验所用的试剂 是____________,反应的离子方程式_____________________
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是_________________现象很壮观,取少许生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现结果的原因,除了可能混有没有反应的磁性氧化铁外,还有一个原因是____________设计一个简单的实验方案,证明上述所得“铁块”中含有金属铝。该实验所用的试剂 是____________,反应的离子方程式_____________________
(2)写出此铝热反应的化学方程式:___________________________每摩尔单质铝参与反应,转移的电子数为___________________
(3)除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以( )
A.CuO B.Na2O2 C .MnO2 D.MgO
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016届湖南省浏阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(12分)某学生为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原得到黑色的Pd)
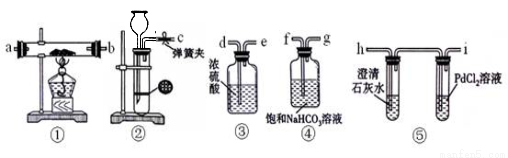
(1)请将上图各装置连接完整(填写装置中字母):c接f, 接 , 接 , 接 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是 。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。
(4)若反应过程中CO2足量,探究钠与CO2充分反应后,生成的固体物质的可能的情况,某同学提出以下猜想:
①生成的固体物质为Na2CO3
②生成的固体物质为Na2CO3和C的混合物
③生成的固体物质为Na2CO3和Na2O的混合物
④生成的固体物质为Na2O和C的混合物
你认为正确的是 (填序号)。
假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体: ;
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留: 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:实验题
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。
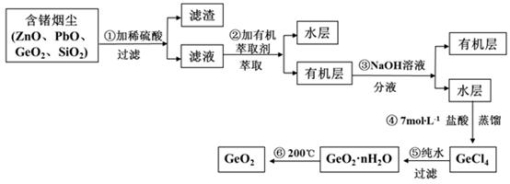
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃;PbO不溶于稀硫酸
(1)第①步滤渣主要成分有 (填化学式),实验室萃取操作用到的玻璃仪器有 。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为 。

(3)第④步加入盐酸作用 (答两点即可)。
(4)第⑤步反应的化学方程式 。
(5)检验GeO2·nH2O是否洗涤干净的操作是 。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为 0.105mol,则该样品中GeO2的物质的量为___________mol
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实验图示转化关系的是
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Al | AlCl3 | NaAlO2 | Al2(SO4)3 | |
D | Fe | FeCl3 | Fe(OH)2 | FeCl2 |
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:填空题
(10分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
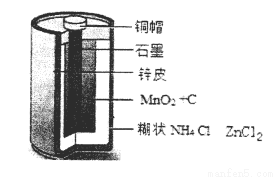
(1)该电池的负极材料是 电池工作时,电子从Zn极流向 填(“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液制取,则MnO2在 极产生。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。(MnO2的摩尔质量为:87g/mol)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期10月月考化学试卷(解析版) 题型:填空题
(12分) 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)写出醋酸的电离方程式:__________________________。
(2)醋酸溶液中存在的微粒有__________________________。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(选填“增大”“减小”或“不变”)__________。
(5)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO-)= (精确值,用表达式表示)。
(6)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加入少量冰醋酸
c.加入少量氯化钠固体
d.加热CH3COOH溶液
e.加入Zn粒
f.加入少量0.10 mol·L-1的CH3COONa溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com