
����һ����Ҫ�Ļ�����Ʒ���ǵ��ʹ�ҵ���л��ϳɹ�ҵ�Լ��������ᡢ��κʹ���ȵ�ԭ�ϡ�
��1����Ϊȼ�Ͽ���������찱ȼ�ϵ�أ����������Ⱦ���ںܶ�����õ��㷺Ӧ�á����缫���Ͼ�Ϊ���Ե缫��KOH��Һ���������Һ����õ�ظ����缫��ӦʽΪ ��
��2����һ���¶��£��ڹ̶�������ܱ������н��п��淴Ӧ��N2+3H2 2NH3���ÿ��淴Ӧ�ﵽƽ��ı�־��________________��
2NH3���ÿ��淴Ӧ�ﵽƽ��ı�־��________________��
A��3v(H2)��=2v(NH3)��
B����λʱ������m mol N2��ͬʱ����3m mol H2
C�������ڵ���ѹǿ������ʱ����仯
D�����������ܶȲ�����ʱ��仯
E��a molN��N�����ѵ�ͬʱ����6amolN—H������
F��N2��H2��NH3�ķ�����֮��Ϊ1��3��2
��3��ij��ѧ�о���ѧϰС��ģ�ҵ�ϳɰ��ķ�Ӧ�����ݻ��̶�Ϊ2L���ܱ������ڳ���1molN2��3molH2��������ʴ�����������Ժ��Բ��ƣ�����һ���¶�ѹǿ�¿�ʼ��Ӧ������ѹ���Ƽ��������ѹǿ�ı仯���£�
| ��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| ѹǿ/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
��ӷ�Ӧ��ʼ��25minʱ����N2��ʾ��ƽ����Ӧ����= �����¶���ƽ�ⳣ��K= ��
��4����CO2��NH3Ϊԭ�Ϻϳ�����[��ѧʽΪCO(NH2)2]����Ҫ��Ӧ���£���֪��
��2NH3(g)+CO2(g) == NH2CO2 NH4(s) ��H= —l59.5 kJ·mol-1
��NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) ��H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) ��H=+116.5 kJ·mol-1
��H2O(1) == H2O(g) ��H=+44.0kJ·mol-1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ ��
����������Ӧ�����ܱ������н�����NH2CO2NH4������300K�·ֽ⣬ƽ��ʱP[H2O(g)]Ϊa Pa������Ӧ�¶Ȳ��䣬����ϵ���������50%����P[H2O(g)]��ȡֵ��Χ��_________________���ú�a��ʽ�ӱ�ʾ��������ѹ=��ѹ�����ʵ���������
��֪ʶ�㡿��ѧƽ�� G1 G2 G3 G4 G5
���𰸽�����24����1��2NH3—6e—+6OH—=N2+6H2O 3��
��2��BCE 3��
��3��0.01 mol/(L.min) 2�� 2.37( mol/L)-2 2��
��4��2NH3(g)+CO2(g)== CO(NH2)2(s) +H2O(l) ��H= — 87.0 kJ·mol-1 2��
2a/3��P[H2O(g)]��a 2��
��������1��ȼ�ϵ��ȼ��Ϊ����������������Ӧ
��2��A������ʾ�����������ʣ���A����B����ȷ��C����Ӧ�����У���������仯ѹǿ�仯����һ������ﵽƽ�⣬C��ȷ��D��m���䣬V���䣬���ܶȲ��䣬����ƽ���־����D����E����ȷ��F��ƽ���־�Ǹ����Ũ�Ȳ��䣬��F����ѡ��BCE
��3����3��ʽ 2L ���ʵ���mol N2+3H2 2NH3
2NH3
��ʼ���ʵ���1 3 0
�仯�� x 3x 2x
ƽ���� 1-x 3-3x 2x
25min��0minѹǿ��Ϊ12.6/16.8=��4-2x��/4��x=0.5mol����N2��ʾ��ƽ����Ӧ����=0.5mol��2L��25min=0.01 mol/(L.min)��ƽ�ⳣ��K=c2��������/c3(����)��c��������= 2.37( mol/L)-2
��4��2NH3(g)+CO2(g)== CO(NH2)2(s) +H2O(l) ��H=—l59.5 kJ·mol-1+116.5 kJ·mol-1-44.0kJ·mol-1= — 87.0 kJ·mol-1
��5������ϵ���������50%����P[H2O(g)]��Ϊ2a/3����ƽ���������ƶ���2a/3��P[H2O(g)]��a
��˼·�㲦���⿼����������ԭ��Ӧ����˹���ɡ���ѧƽ���֪ʶ�㣬����������ԭ��Ӧʵ�ʡ���˹�����ں�����ѧƽ����жϷ�����֪ʶ�������������Щ֪ʶ�㶼�Ǹ߿��ȵ㣬���������ڴ����ۺ����У�ע�����غ�˼�����������⣬��Ŀ�Ѷ��еȣ�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и���������ָ����Һ���ܴ���������ǣ� ��
A��pH=1����Һ�У�Fe2+��NO3—��SO42—��Na+
B����ˮ�������c(H+)=1��10-14 mol·L-1����Һ�У�Ca2+��K+��Cl—��HCO3—
C��c(H+)/c(OH—)=1012����Һ�У�NH4+��Al3+��NO3—��Cl—
D��c(Fe3+)=0.1 mol·L-1����Һ�У�K+��ClO—��SO42—��SCN—
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ϩ(hericenes)����״���������̵Ķ�������ʽ����ͼ�������йغ���ϩ��˵����ȷ����(����)
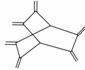
A������ϩ����ϩ��Ϊͬϵ��
B������ϩ����������ԭ����ͬһƽ����
C������ϩ�ķ���ʽΪC14H20
D������ϩ��ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij���Ľṹ�ü���ʽ��ʾΪ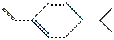 ��������Br2�����ʵ���֮��Ϊ1��1�ӳ�ʱ�����ò�����(����)
��������Br2�����ʵ���֮��Ϊ1��1�ӳ�ʱ�����ò�����(����)
A��3�� B��4�� C��5�� D��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ij���л���Ľṹ��ʽΪ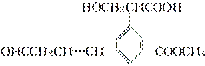 ����ش�
����ش�
(1)������һ�������к���______������̼ԭ�ӣ�________��������̼ԭ�ӡ�
(2)������˫���м���________��������______________________________________��
(3)д���������к��еĹ����ŵ�����________________________________________
____________________________��
(4)д�����л���ķ���ʽ________����̼�ĹǼܲ��䡢���������Ͳ����ǰ���£�д�����л��������ͬ���칹��______________________��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з������������ִ���ѧ�ⶨ�л���ṹ�ķ�������(����)
A��ȼ�շ� B���������
C��������� D���˴Ź���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ϩ�����е�����ԭ�Ӷ���һ��ƽ���ϡ�������һ��������������һ����Ҫ���л��Լ�M���˴Ź���������M�����е���ԭ��û�����𣬺��������M����������ʻ�
(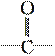 )����M����������ԭ����һ��ƽ���ϡ�M������ˮ��Ӧ���±�Ϊ���ᣬ��M���ӵĽṹ��ʽ������(����)
)����M����������ԭ����һ��ƽ���ϡ�M������ˮ��Ӧ���±�Ϊ���ᣬ��M���ӵĽṹ��ʽ������(����)
A��(CH3CO)2O B��CH2===CO
C��CH3CHO D��HCHO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��2.00g C2H2��ȫȼ������Һ̬ˮ��CO2���ų�99.6kJ��������д����ʾC2H2ȼ���ȵ��Ȼ�ѧ����ʽ��
��2��C2H2����������ȼ�ϵ�أ���д��KOH��ҺΪ�������Һ����Ȳȼ�ϵ�صĸ�����Ӧʽ��
��3������Ȳȼ�ϵ�ص��AgNO3��Һ����ʯī��������������д�����Դ����������ʯī�缫�ĵ缫��Ӧʽ��
��4�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
��д���õ���ڳ��ʱ�����ĵ缫��Ӧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������˵���У��������( ����)
�ٺϽ�ȴ��������нϺõ����ܣ�Ӳ�ȶ��ȳɷֽ������۵�ȳɷֽ����ĵ�
�ڳ��õ�ⷨұ���ơ�þ�����Ȼ��ý���
�۽���բ�����Դ�����������ɷ�ֹ���ں�ˮ�б���ʴ
��Fe�ڳ����¿���Ũ���ᡢϡ���ᡢŨ������ҷ�Ӧ
��Al��Cl2���ܺ�NaOH��Һ����������ԭ��Ӧ���������ʵ�������ͬ
��Na�����ڿ����У����ԺͿ����е��й����ʷ�����Ӧ����������Na2CO3
���Ʊ�FeCl3��CuCl2������ɲ��ý���Һֱ�����ɵķ���
A���٢ڢ� B���ܢ� C���ۢܢ� D���ۢܢݢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com