
【题目】如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是

A. X的相对分子质量等于Y的相对分子质量
B. X的相对分子质量比Y的相对分子质量小
C. 气体的体积:V(X) >V(H2)>V(Y)
D. 物质的质量:n(X)< n(H2) <n(Y)
【答案】A
【解析】
在A、B、C处分别充入等质量的X、H2、Y三种气体,且X、Y气体的密度相等,而气体的摩尔质量M=ρ×Vm,所以气体的摩尔质量相等,即相对分子质量相等;气体的物质的量n= ![]() ,而气体的摩尔质量相等,所以物质的量相等;相同温度、压强下X、Y的气体物质的量相同,所以X与Y的体积相同。A、X、Y气体的密度相等,而气体的摩尔质量M=ρ×Vm,所以气体的摩尔质量相等,即相对分子质量相等,故A正确;B、根据A的分析,B错误;C、相同温度、压强下X、Y的气体,其物质的量相同,所以X与Y气体的体积相同,故C错误;D、气体的物质的量n=
,而气体的摩尔质量相等,所以物质的量相等;相同温度、压强下X、Y的气体物质的量相同,所以X与Y的体积相同。A、X、Y气体的密度相等,而气体的摩尔质量M=ρ×Vm,所以气体的摩尔质量相等,即相对分子质量相等,故A正确;B、根据A的分析,B错误;C、相同温度、压强下X、Y的气体,其物质的量相同,所以X与Y气体的体积相同,故C错误;D、气体的物质的量n= ![]() ,而气体的摩尔质量相等,所以X、Y的气体的物质的量相等,故D错误;故选A。
,而气体的摩尔质量相等,所以X、Y的气体的物质的量相等,故D错误;故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) △H1 = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H2 = -566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:__________________________________________
(2)甲醇作为燃料,优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧16g甲醇,生成二氧化碳和水蒸汽时,放出的热量为_____ kJ ,生成的CO2气体标准状况下体积是______L。
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在______极反应;电极反应式为____________________________________________。
(4)某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。
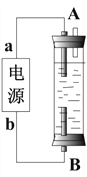
下列说法中正确的是___________(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl 溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将2molSO2和lmolO2充入10L恒容密闭容器中,发生反应 2SO2(g) +O2(g) ![]() 2SO3(g) △H=-196 kJmol-1,5min时达到平衡,测得反应放热166.6 kJ。下列说法错误的是
2SO3(g) △H=-196 kJmol-1,5min时达到平衡,测得反应放热166.6 kJ。下列说法错误的是
A. 05 min内,用O2表示的平均反应速率v(O2)=0.017 molL-1 min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,起始向容器中充入4 mol SO2和 2 mol O2,平衡时放热小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使2molN2和6molH2混合发生反应:N2(g)+3H2(s)![]() 2NH3(g),(正反应为放热反应)下列说法错误的是
2NH3(g),(正反应为放热反应)下列说法错误的是
A. 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B. 升高平衡体系的温度(保持体积不变),混合气体的密度不变
C. 当反应达到平衡时,N2和H2的浓度比是1∶3
D. 当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
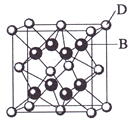
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com