
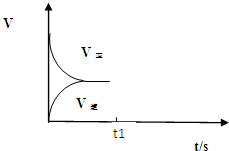 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯.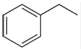 (g)→
(g)→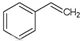 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol分析 (1)①根据盖斯定律,结合已知方程式计算反应热,然后写热化学方程式;
②方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)A、升高温度正逆反应速率均增大;
B、增大反应物,平衡正向移动;
C、若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率减小;
D、压缩体积,平衡不移动,反应物和产物的浓度都增大;
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大;
(4)根据Ag2SO4的KspAg2SO4=0.36×10-6进行计算.
解答 解:(1)①已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②: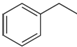 (g)→
(g)→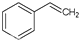 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;
根据盖斯定律:①+②,得 CO2(g)+ (g)+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol;
(g)+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol;
故答案为:CO2(g)+ (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol;
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol;
②、反应①与法院②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1•K2;
故答案为:K1•K2;
(2)A、升高温度增大了活化分子百分数,有效碰撞几率增大,正逆反应速率均增大,故A错误;
B、若继续加入1mol CO2、1mol H2,与原平衡的初始量是等比例加入,反应物的浓度增大,则平衡向正反应方向移动,故B正确;
C、若继续通入1mol CO2,反应物的浓度增大,则平衡向正反应方向移动,由于平衡移动程度较小,CO2的转化率减小,故C错误;
D、该反应为总体积不变的反应,压缩体积,平衡不移动,但是反应物和产物的浓度都增大,故D错误;
故答案为:B;
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: ,故答案为:
,故答案为: ;
;
(4)设AgNO3的浓度为x,又知KspAg2SO4=0.36×10-6则:
x=$\sqrt{\frac{0.36×1{0}^{-6}}{0.01}}$=6×10-3,
故答案为:6×10-3.
点评 本题考查了热化学方程式的书写、平衡常数K的应用、影响速率及平衡的因素、Ksp的计算、电解原理的应用等,题目涉及的知识点较多,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
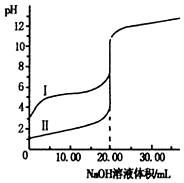 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com