
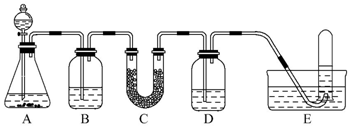
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
分析 由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,以此解答该题.
解答 解:由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
(1)A为由CaCO3和盐酸反应生成CO2,方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,由于生成的氧气中混有二氧化碳气体,应用NaOH溶液洗气,吸收未反应的CO2气体,用排水法收集O2,
故答案为:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| C | Na2O2 | 反应生成O2 |
| D | NaOH溶液 | 吸收没有反应的CO2 |
点评 本题考查了性质试验方案的设计与评价,题目难度中等,明确过氧化钠与二氧化碳以及和水反应的原理为解答关键,注意掌握性质试验方案的设计与评价原则,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5 NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于C | B. | 小于C | C. | 等于C | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.
x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com