
 计算空气的物质的量,再根据N=NA计算分子数目.
计算空气的物质的量,再根据N=NA计算分子数目. 计算乙烯和丙烯的物质的量,每个乙烯分子中含有6对共用电子对,每个丙烯分子中含有9对共用电子对,再根据N=nNA计算共用电子对数.
计算乙烯和丙烯的物质的量,每个乙烯分子中含有6对共用电子对,每个丙烯分子中含有9对共用电子对,再根据N=nNA计算共用电子对数. .
.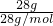 =1mol,每个乙烯分子中含有6对共用电子对,所以28g乙烯含有共用电子对数为1mol×6×NAmol-1=6NA,28g丙烯的物质的量为
=1mol,每个乙烯分子中含有6对共用电子对,所以28g乙烯含有共用电子对数为1mol×6×NAmol-1=6NA,28g丙烯的物质的量为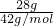 =
= mol,每个丙烯分子中含有9对共用电子对,所以28g丙烯含有共用电子对数为
mol,每个丙烯分子中含有9对共用电子对,所以28g丙烯含有共用电子对数为 mol×9×NAmol-1=6NA,二者均含有6NA对共用甩子对,故C正确;
mol×9×NAmol-1=6NA,二者均含有6NA对共用甩子对,故C正确;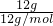 =1mol,石墨晶体中邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德华力联成互相平行的平面,构成层状结构结构,每个共价键给碳原子提供
=1mol,石墨晶体中邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德华力联成互相平行的平面,构成层状结构结构,每个共价键给碳原子提供 ,所以12g石墨晶体中碳碳键的数目为1mol×3×
,所以12g石墨晶体中碳碳键的数目为1mol×3× ×NAmol-1=1.5NA,故D正确.
×NAmol-1=1.5NA,故D正确.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com