

分析 铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3,由流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸,则沉淀A为SiO2;滤液X中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氯化铝全部反应得到滤液Y中含偏铝酸钠和氯化钠、NaOH,氢氧化铁加热分解生成B为氧化铁,以此来解答.
解答 解:由流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸,则沉淀A为SiO2;滤液X中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氯化铝全部反应得到滤液Y中含偏铝酸钠和氯化钠、NaOH,氢氧化铁加热分解生成B为氧化铁,
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤,故答案为:过滤;
(2)由上述分析可知A为SiO2,B为Fe2O3,故答案为:SiO2;Fe2O3;
(3)X中含铁离子,取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成血红色;滤液Y是偏铝酸钠、氯化钠溶液,溶液中的阴离子除OH-、Cl-外,还有AlO2-,
故答案为:血红;AlO2-;
(4)(Ⅱ)步骤中生成Fe(OH)3的离子反应为氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,
故答案为:Fe3++3OH-=Fe(OH)3↓.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的综合考查,注意试剂过量及滤液成分的分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化:
 或
或 .
. +n NH2CH2(CH2)4CH2NH2$\stackrel{一定条件}{→}$
+n NH2CH2(CH2)4CH2NH2$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与盐酸反应的化学方程式为:FeS2+2HCl═FeCl2+S↓+H2S↑ | |
| B. | 在FeS2中,硫元素的化合价与辉铜矿(主要成分是Cu2S)中硫元素的化合价相同 | |
| C. | FeS2中的Fe元素位于第4周期第ⅧB族 | |
| D. | 若FeS2在空气中燃烧时生成Fe2O3和SO2,则1mol FeS2在反应中将失去6mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
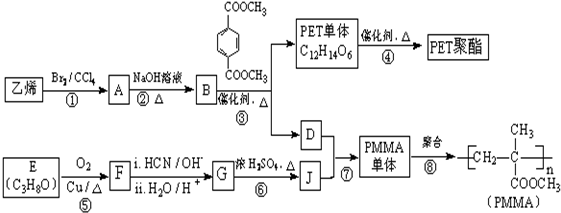
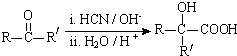 (R、R′代表烃基,可相同也可不同)
(R、R′代表烃基,可相同也可不同)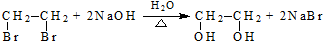 .
. .
.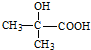 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量醋酸钠晶体后,两溶液的pH均增大 | |
| B. | 将温度升高至50℃,两溶液的pH均不变 | |
| C. | 加水稀释至原体积的2倍后,两溶液的pH均减小 | |
| D. | 加入足量锌粉充分反应后,两溶液产生氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉放出H2的溶液中:Al3+、K+、SO42-、Cl- | |
| B. | 1.0 mol•L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- | |
| C. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液中:K+、Cu2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com