
| A. | 3种 | B. | 4种 | C. | 8种 | D. | 6种 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1配制250mL0.10mol•L-1盐酸 | B. | 图2稀释浓硫酸 | ||
| C. | 图3称量氯化钠固体 | D. | 图4CCl4萃取碘水的分液操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | 2.4mol | C. | 2.2mol | D. | 3.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | SO32-、SO42-、H+、K+ | ||
| C. | Fe2+、Fe3+、Cu2+、Cl- | D. | Ba2+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
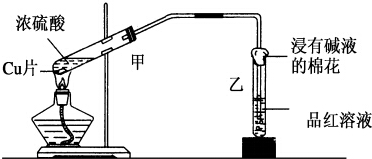 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com