
某化学反应2A
 B+D在四种不同条件下进行。B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内的平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=______mol·L-1,反应经20 min就达到了平衡,可推测实验2中还隐含的条件是____________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______v1(填“>”、“=”或“<”),且c3______1.0 mol·L-1(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应的正反应是______反应(填“吸热”或“放热”),理由是________________________________________________________________________。
答案 (1)0.013 (2)1.0 使用了催化剂
(3)> >
(4)吸热 温度升高时,平衡向右移动
解析 (1)v(A)= =0.013 mol·L-1·min-1
=0.013 mol·L-1·min-1
(2)对比实验1与实验2可知,反应温度相同,达平衡时的A的浓度相同,说明是同一平衡状态,即c2=1.0 mol·L-1,又因实际反应的速率快,达平衡所需时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min至20 min,实验1中A的浓度变化值为0.13 mol·L-1,而实验3中A的浓度变化值为0.17 mol·L-1,这说明了v3>v1。又知从0 min到10 min,A的浓度变化值应大于0.17 mol·L-1,即c3>(0.92+0.17) mol·L-1=1.09 mol·L-1。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4中A的浓度小,说明了实验中A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
美丽的“水立方”(Water Cube)是北京奥运会游泳馆,采用膜材料ETFE(四氟乙烯和乙烯的共聚物),为场馆带来更多的自然光。下列说法正确的是( )
A.ETFE的结构中,存在—CF2—CH2—连接方式
B.四氟乙烯与乙烯发生缩聚反应得到ETFE
C.以乙烯为原料经过加成反应、取代反应可制得乙二醇
D.ETFE材料是热固型(体型结构)的塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
石油裂解气中含有重要的有机化工原料乙烯和1,3丁二烯,用它们经过下面框图的反应流程,可以合成用于制造增强塑料(俗称玻璃钢)的高分子化合物H(结构简式如下图所示)。
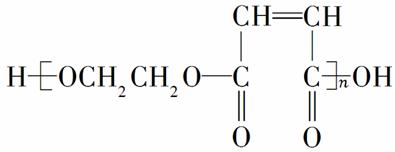
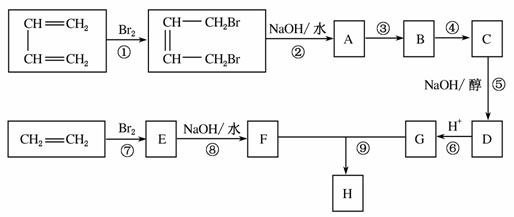
请按要求填空:
(1)写出下列反应的反应类型:反应①________,反应⑤________,反应⑨________。
(2)反应③、④中有一反应是与HCl加成,该反应是____________(填反应编号),设计这一步反应的目的是____________________,物质C的结构简式是__________________。
(3)反应②的化学方程式是________________________________ _____________,反应⑧的化学方程式是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y
 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氯化氢的摩尔质量为36.5g
B.1molH2SO4 的质量为98g·mol-1
C.任何物质的摩尔质量都等于他的相对分子质量或相对原子质量
D.CO2的摩尔质量是H2 的摩尔质量的22倍
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,
某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,
杂质是空气和水蒸气。回答下列问题:
(1)该项研究(实验)的主要目的是_______________________________。
(2)浓硫酸的作用是____________________,与研究目的直接相关的实验现象是
_______________________________、_______________________________。
(3)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是____________。请在图中的D处以图的形式表明克服事故隐患的措施。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ·mol-1
③ H2SO4(l)+NaOH(l)===
H2SO4(l)+NaOH(l)=== Na2SO4(l)+H2O(l)
Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ·mol-1
④C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
⑤CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)===2H2O(l)
ΔH=-517.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有_________________________________________,
不正确的理由分别是____________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:
________________________________________________________________________。
(3)上述反应中,表示标准燃烧热的热化学方程式有________________________________;
表示中和热的热化学方程式有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在同一溶液中一定能大量共存的是( )
A.含大量Ba2+的溶液中:Cl-、K+、SO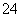 、CO
、CO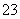
B.含大量H+的溶液中:Mg2+、Na+、CO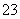 、SO
、SO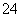
C.含大量OH-的溶液中:K+、NO 、SO
、SO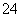 、Cu2+
、Cu2+
D.含大量Na+的溶液中:H+、K+、SO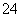 、NO
、NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com