
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
A.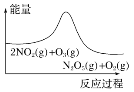 平衡后降温,NO2含量降低
平衡后降温,NO2含量降低
B.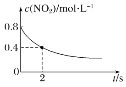 0~2 s内,υ(O3)=0.2 mol·L-1·s-1
0~2 s内,υ(O3)=0.2 mol·L-1·s-1
C.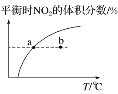 υ正:b点<a点,b点:υ逆<υ正
υ正:b点<a点,b点:υ逆<υ正
D.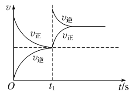 恒温,t1时再充入O3
恒温,t1时再充入O3
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作正确的是
实验目的 | 实验操作 | |
A | 配制浓度为0.010 | 用托盘天平称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
B | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
C | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
D | 排水法收集KMnO4分解产生的O2 | 先移出导管,后熄灭酒精灯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红钠矾(重铬酸钠: Na2Cr2O72H2O )是重要的基础化工原料,易溶于水,有强氧化性 ,极毒。2012 年中国科学院研究所发明了以铬酸钡为中间体,由铭酸钾制备高纯度重铬酸钠的方法。该方法的转化条件温和,污染物排放少,流程如下所示。
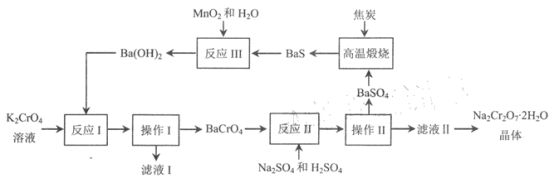
回答下列问题:
(1)操作I和操作II的名称均是 ____________, 滤液 I中溶质的主要成分的化学式为_____________。
(2)反应I、II、III中属于氧化还原反应的是____________________。
(3)高温煅烧时需加入过量焦炭,发生反应的化学方程式为 ________________.
(4)从平衡角度分析,反应 II 加H2SO4调节 pH 的原因是_______________(用离子方程式表示); 反应 II 不能用 HCl 替代H2SO4 的原因是_________________。
(5)含Cr2O72- 的废水需经化学处理,使其浓度降至符合国家有关标准方可排放。通常可在酸性废水中先加入适量绿矾(FeSO47H2O ) ,将Cr2O72- 还原成Cr3+,发生反应的离子方程式为___________, 再加入过量的石灰水,使 Cr3+转变为Cr(OH)3沉淀。用该方法处理 c(Cr2O72-) =1.5×10-3 mol·L-1的废水 10 m3,至少需要绿矾______kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
实验橾作 | 现象 |
I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)①_____ |
IV.继续加入适量 Ba(OH)2 溶液 | ②______ |
V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________、 _______________。
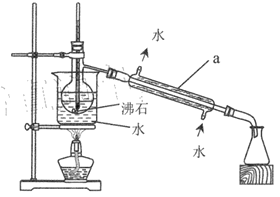
(3)操作III加入适量Na2SO3 发生反应的离子方程式为 __________。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂 __________检验。若观察到的现象为________,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示方法不能完成相应实验的是
A.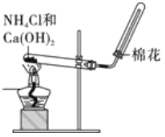 实验室制取并收集NH3
实验室制取并收集NH3
B.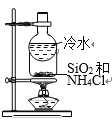 分离SiO2和NH4Cl
分离SiO2和NH4Cl
C. 检验草酸晶体中是否含有结晶水
检验草酸晶体中是否含有结晶水
D.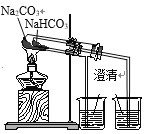 验证热稳定性:Na2CO3>NaHCO3
验证热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。
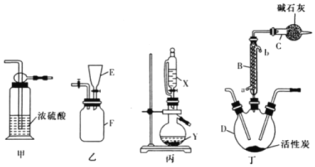
(1)化合物SO2Cl2中S元素的化合价为__。
(2)仪器D的名称是___。
(3)乙、丙装置制取原料气Cl2与SO2。
①乙装置F中充满Cl2,则E中所盛放的溶液为___(填溶液的名称)。
②丙装置中试剂X、Y的组合最好是__。
A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3 C.浓HNO3+Na2SO3
(4)上述装置的正确连接顺序为__、__、丁、__、__(用甲、乙、丙表示,可重复使用)__。
(5)B装置中从a口通入冷水的作用是__;C装置的作用是__。
(6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为__。
(7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为__(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com