
 ,故答案为:
,故答案为: ;
;
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

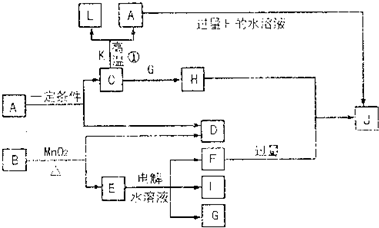
请填空:?
(1)D的元素与I的元素能形成原子个数比为1∶1的共价化合物,其电子式为 。?
(2)写出用石墨作电极,电解E水溶液的离子方程式 。气体G在 极逸出(填“阳”或“阴”)。?
(3)写出C+K→L+A的化学方程式 ,指出引发此反应的方法: 。
(4)写出A+F→J的离子方程式 。?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三第二次综合考试化学试卷(解析版) 题型:填空题
(10分)水是生命之源,也是化学反应中的主角。请回答下列问题:(下列问题
所涉及的答案可能有多种,只需答出一种情况即可)
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
。
Ⅱ.有以下五组离子① K+、Cl-、NO3-、S2- ;② K+、Fe2+、I-、SO42- ;③ Na+、Cl-、
NO3-、SO42- ; ④Na+、Ca2+、Cl-、HCO3- ;⑤ K+、Ba2+、Cl-、NO3-。在由水电离产生的
c(OHˉ)= 1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是 (填序号)
Ⅲ.在许多反应中H2O扮演不同的“角色”。请结合所学完成下列反应
(1)H2O参与的置换反应:符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水 ,离子方程式为 ;
②V是水, 化学方程式为 。
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O ;
②B + H2O ;
查看答案和解析>>
科目:高中化学 来源:2013届福建省高一下学期第一学段考试化学试卷 题型:填空题
(12分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
(1)A分子的空间构型为 ;Y在周期表中的位置 ;
(2)写出气体D通入水中的化学反应方程式________________________;[来源:学&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式: ,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com