解:(1)实验室用亚硫酸钠固体与硫酸反应制取SO
2气体,反应方程式为:Na
2SO
3+H
2SO
4═Na
2SO
4+SO
2↑+H
2O;
a.10%的H
2SO
4溶液,SO
2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,由于SO
2气体是易溶于水的气体,所以不能选择10%的H
2SO
4溶液,故a错误;
b.80%的H
2SO
4溶液,由于SO
2气体是易溶于水的气体,用浓硫酸可以降低二氧化硫在水中的溶解度,故b正确;
c.Na
2SO
3固体,Na
2SO
3固体易溶于水,保证反应均匀进行,故C正确;
d.CaSO
3固体,由于CaSO
3固体与硫酸反应生成的CaSO
4固体微溶,容易在CaSO
3固体表面形成一层薄膜阻止反应的进行,故d错误;
故答案为:bc;
(2)气体的制取装置的选择与反应物的状态、溶解性和反应的条件有关;实验室用亚硫酸钠固体与硫酸反应制取SO
2气体,反应方程式为:Na
2SO
3+H
2SO
4═Na
2SO
4+SO
2↑+H
2O,该制取所需装置为固体和液体反应不需加热制取气体,因Na
2SO
3固体易溶于水,选①无法控制反应的开始和停止和反应的速率,故选⑥,
故答案为:⑥;
(3)装置①的特点,固体与液体反应,不需要加热,且固体难溶于水,便于控制反应,a.Na
2S固体b.NaHS固体都是易溶于水的固体,故不正确,FeS
2颗粒虽难溶于水但与酸发生:FeS
2+H
2SO
4=H
2S
2+FeSO
4,H
2S
2类似于H
2O
2,易分解,发生H
2S
2=H
2S↑+S↓,显然不及用FeS固体与稀H
2SO
4反应制取H
2S气体副产物少,反应快,因此实验室用FeS固体和稀硫酸反应制取H
2S气体,FeS+H
2SO
4═FeSO
4+H
2S↑,用FeS固体与稀H
2SO
4反应制取H
2S气体,是固液常温型反应,所以c正确,
故答案为:c;
(4)装置①为简易的制取气体装置,对于该装置的气密性检查,主要是通过气体受热后体积膨胀、压强增大或压强增大看体积变化来进行检验.如夹紧止水夹,向长颈漏斗中加水至其液面高于试管中的液面,一段时间后,看液面高度差有无变化,说明变化装置漏气,反之不漏气,
故答案为:夹紧止水夹,向长颈漏斗中加水至其液面高于试管中的液面,一段时间后,液面高度差无变化,说明装置不漏气;
(5)证明SO
2具有氧化性,利用二氧化硫与硫化氢发生氧化还原反应,生成单质S和水,该反应为SO
2+2H
2S═3S↓+2H
2O,二氧化硫中+4价的S元素的化合价降低为产物中的0价,二氧化硫表现氧化性,实验现象为瓶壁上有淡黄色粉末为S和无色小液滴H
2O,
故答案为:瓶壁上有淡黄色粉末和无色小液滴;
(6)实验室制取乙烯的原理是CH
3CH
2OH
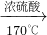
CH
2=CH
2↑+H
2O,需酒精灯加热,需温度计测反应的温度,故答案为:酒精灯、温度计;
(7)探究乙酸、碳酸和苯酚的酸性强弱,依次选择了装置①、②、④,选择装置①乙酸和碳酸钙反应生成二氧化碳,乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚;选择装置②盛有饱和NaHCO
3溶液,防止醋酸干扰实验,在气态未和苯酚反应前将其除去,除去醋酸且又不引进新的杂质气体;选择装置④盛有苯酚钠溶液,目的是使二氧化碳、水和苯酚钠反应生成苯酚和碳酸氢钠,现象是溶液出现浑浊,反应离子方程式为:C
6H
5O
-+CO
2+H
2O→C
6H
5OH+HCO
3-,根据强酸制取弱酸的原则,酸性:乙酸>碳酸>苯酚,
故答案为:饱和碳酸氢钠溶液;苯酚钠溶液.
分析:(1)根据SO
2气体易溶于水以及CaSO
4固体微溶等性质选择制取SO
2的合适试剂;
(2)根据二氧化硫的反应原理:使用固体+液体反应,不需加热选择装置;
(3)根据装置①的特点,固体与液体反应,不需要加热,且固体难溶于水,便于控制反应的特点解答;
(4)根据检查装置气密性的原理:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏分析解答;
(5)二氧化硫与硫化氢发生氧化还原反应生成单质S和液态水解答;
(6)乙醇在浓硫酸的作用下,加热到170℃时生成乙烯,据此分析所需仪器;
(7)探究乙酸、碳酸和苯酚的酸性强弱,依次选择了装置①、②、④,根据比较酸性强弱的原理和相关的装置①、②、④的作用进行解答.
点评:本题考查二氧化硫的性质、气体的制取装置的选择、乙酸、碳酸和苯酚的酸性强弱的探究,题目较为综合,明确各装置的作用及发生的化学反应是解答本题的关键,题目难度中等.


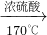 CH2=CH2↑+H2O,需酒精灯加热,需温度计测反应的温度,故答案为:酒精灯、温度计;
CH2=CH2↑+H2O,需酒精灯加热,需温度计测反应的温度,故答案为:酒精灯、温度计;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

