
| A. | 电解NaOH溶液时,溶液浓度将增大,pH增大 | |
| B. | 电解H2SO4溶液时,溶液浓度将增大,pH增大 | |
| C. | 电解Na2SO4溶液时,溶液浓度将增大,pH不变 | |
| D. | 电解NaCl溶液时,溶液浓度将减小,pH不变 |
分析 A.用惰性电极电解NaOH溶液时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于水解水,导致c(NaOH)增大;
B.电解稀硫酸时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于水解水,导致硫酸浓度增大;
C.电解硫酸钠溶液时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于水解水,导致硫酸钠浓度增大;
D.电解饱和NaCl溶液时,阴极上氢离子放电、阳极上氯离子放电,所以导致溶液中氯化钠浓度降低,但溶液中有NaOH生成.
解答 解:A.用惰性电极电解NaOH溶液时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于水解水,导致c(NaOH)增大,溶液的pH增大,故A正确;
B.电解稀硫酸时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于水解水,导致硫酸浓度增大,溶液的pH减小,故B错误;
C.电解硫酸钠溶液时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于水解水,导致硫酸钠浓度增大,但硫酸钠是强酸强碱盐,其溶液呈中性,pH不变,故C正确;
D.电解饱和NaCl溶液时,阴极上氢离子放电、阳极上氯离子放电,所以导致溶液中氯化钠浓度降低,但溶液中有NaOH生成,溶液的pH增大,故D错误;
故选AC.
点评 本题考查电解原理,为高频考点,明确离子放电顺序、电解后溶液中溶质及其浓度变化是解本题关键,易错选项是C.


科目:高中化学 来源: 题型:解答题
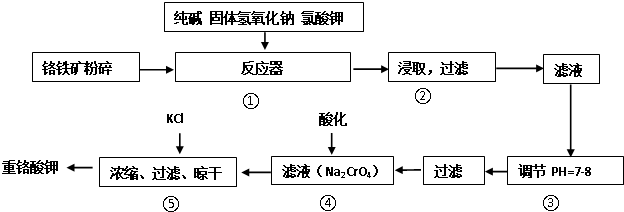
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 牙膏品牌 | 某儿童牙膏 | 某防臭牙膏 | 某透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
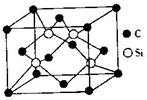 氮化硅是一种重要的结构陶瓷材料,具有优良性能.
氮化硅是一种重要的结构陶瓷材料,具有优良性能.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com