
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量多 | |
| D. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
分析 A.吸放热反应与条件无关;
B.浓硫酸稀释放热;
C.H2O(g)变化为H2O(l)为放热过程;
D.在101kPa时,1mol碳完全燃烧生成二氧化碳气体时所放出的热量为碳的燃烧热.
解答 解:A.需要加热方能发生的反应不一定为吸热反应,如铝热反应,故A错误;
B.稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,浓硫酸稀释放热,所以放出的热量大于57.3kJ,故B正确;
C.H2O(g)变化为H2O(l)为放热过程,则等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量少,故C错误;
D.在101kPa时,1mol碳完全燃烧生成二氧化碳气体时所放出的热量为碳的燃烧热,若不完全燃烧放出的热量就不是碳的燃烧热,故D错误.
故选B.
点评 本题考查了燃烧热、中和热的定义要点以及反应吸放热多少的判断,难度中等,侧重于基础知识应用的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液可以洗涤油污 | B. | 用pH试纸可以测定土壤的酸碱性 | ||
| C. | 用明矾可以对自来水杀菌病毒 | D. | 含氟牙膏可以有效防止龋齿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为s轨道的形式是球形的,所以处于s轨道上的电子做的是圆周运动 | |
| B. | 电子在3px、3py、3ps三个轨道上运动时,能量不同 | |
| C. | 电子云是用来形象的描述电子运动状态的 | |
| D. | H、F、Cl、O的电负性逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.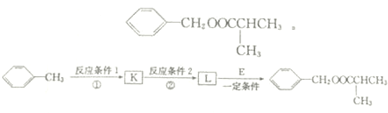 反应②所选用的试剂为氢氧化钠溶液,L的结构简式为
反应②所选用的试剂为氢氧化钠溶液,L的结构简式为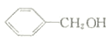 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g H2O中含有氧原子数为2NA | |
| B. | 标准状况下,11.2L苯所含分子数为0.5NA | |
| C. | 1L 1 mol•L-1硫酸钠溶液中,所含钠离子数为NA | |
| D. | 1mol H2在O2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com