
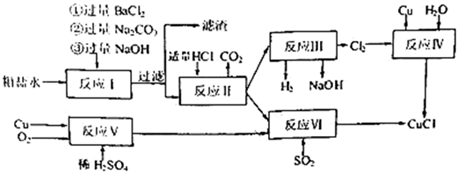
分析 由流程分析,粗盐水加入过量氯化钡沉淀硫酸根离子,加入过量氢氧化钠沉淀镁离子,最后加入碳酸钠沉淀过量的钡离子、钙离子,过滤后加入盐酸除去过量的碳酸钠,得到较纯净的氯化钠溶液,电解得到氢氧化钠溶液,氢气和氯气,利用生成的氯气和过量铜反应生成氯化亚铜;也可以利用铜、氧气、稀硫酸反应生成硫酸铜通入二氧化硫还原得到氯化亚铜,
(1)粗盐提纯中加入氯化钡溶液时沉淀硫酸根离子,步骤①②不能交换,否则加入过量的氯化钡溶液中钡离子不能除去;
(2)煅烧硫铁矿制取二氧化硫,二硫化亚铁和氧气反应生成氧化铁和二氧化硫,工业制备硫酸的过程中将二氧化硫转变为三氧化硫的设备名称为接触室;
(3)依据流程分析反应Ⅴ是铜和氧气,稀硫酸反应生成硫酸铜和水;
(4)二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀;
(5)乙醇和水易挥发,CuCl具有还原性,可以被空气氧化;
(6)依据反应过程中铜元素守恒计算.
解答 解:(1)反应I中加BaCl2溶液的作用是沉淀硫酸根离子,步骤①②不能交换,原因是过量的Ba2+无法除去,
故答案为:沉淀硫酸根离子;过量的Ba2+无法除去;
(2)煅烧硫铁矿制取二氧化硫,二硫化亚铁和氧气反应生成氧化铁和二氧化硫,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,工业制备硫酸的过程中将二氧化硫转变为三氧化硫的设备名称为接触室,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;接触室;
(3)流程分析反应Ⅴ是铜和氧气,稀硫酸反应生成硫酸铜和水,反应的化学方程式为:2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(4)二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,即2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
(5)CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(6)2Cu+O2+2H2SO4=2CuSO4+2H2O,2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,反应过程中依据铜元素守恒计算,320g铜经反应V和反应VI制CuCl,若反应V中铜的转化率为90%,反应VI中硫酸铜的损失率为5%,可得到95%的CuCl的质量=$\frac{320g×90%×(1-5%)}{64g/mol×95%}×99.5g/mol$=447.75g,
故答案为:447.75g.
点评 本题涉及物质的分离和提纯的方法以及操作、化学方程式书写与技术等方面的知识,注意知识的迁移和应用是解题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A.Na+、Ba2+、Cl?、SO42-
B.Ca2+、HCO3?、C1?、K+
C.MnO4?、K+、I?、H+
D.H+ 、Cl? 、Na+ 、CO32?
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
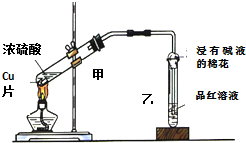 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
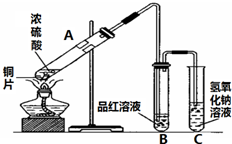 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
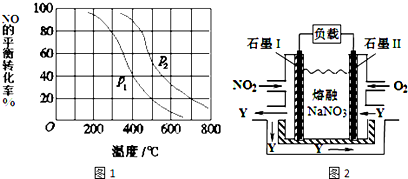
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
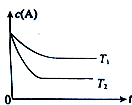 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com