
化学与生产、生活密切相关。下列叙述错误的是
A.光导纤维和陶瓷都是硅酸盐产品
B.晶体硅可用于制造芯片
C.钢铁厂用热还原法冶炼铁
D.焙制糕点的发酵粉主要成分之一是碳酸氢钠
科目:高中化学 来源: 题型:
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为_______________________________________;
(2)Mn基态原子核外处在能量最高的能级上的电子共有________种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为_________________________________;
② HCHO分子中C原子轨道的杂化类型为___________________________________;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH) 4]2-的结构可用示意图表示为______________________________;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是________________________g(保留两位小数);阿伏加德罗常数为_____________________________________(列式计算,保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
C.含1 mol FeCl3的溶液中Fe3+的个数为NA
D.1.8g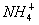 中含有的电子数为0.1NA
中含有的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L SO3中所含有分子数为NA
B.常温下,28 g 乙烯和丙烯的混合物中所含化学键一定为6NA
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定为4NA
D.1 L 1mol/L NH4NO3溶液中氮原子数目小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
家用管道煤气的主要成分是CO、H2、CH4,取1 L管道煤气充分燃烧需要同温同压下的空气5 L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能
A.1∶1∶1 B.1∶1∶2 C.2∶4∶3 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.11.2 L CO2所含分子数为0.5 NA
B.1 L 0.1 mol·L-1的Na2S溶液中离子数为0.3 NA
C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
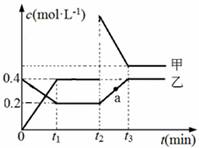
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是
A.甲是N2O4
B.a点处于平衡状态
C.t1~t2时间内v正(乙)<v逆(甲)
D.反应进行到t2时刻,改变的条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
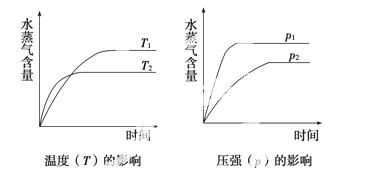
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g);ΔH<0
CO(NH2)2(s)+H2O(g);ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g);ΔH>0
CO(g)+H2O(g);ΔH>0
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g);ΔH>0
CH2===CH2(g)+H2O(g);ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g);ΔH<0
2C6H5CH===CH2(g)+2H2O(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
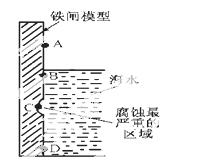
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com