
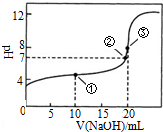
 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点③所示溶液中:c(CH3COO-)>c(Na+) |
分析 A.在滴定中当加入碱比较少时,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)的情况;
B.根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,溶液显酸性,结合物料守恒进行判断;
C.点③体积相同,则恰好完全反应生成CH3COONa,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
D.点③说明两溶液恰好完全反应生成CH3COONa,CH3COO-水解溶液显碱性.
解答 解:A.当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故A正确;
B.点①反应掉一半醋酸,反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,溶液中物料守恒得到2c(Na+)=c(CH3COOH)+c(CH3COO-),故B错误;
C.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,且程度较小,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,c(CH3COO-)<c(Na+),故D错误;
故选A.
点评 本题考查离子浓度大小比较,题目难度中等,明确混合后溶液中的溶质是解答的关键,注意电荷守恒和物料守恒的应用,试题培养了学生灵活应用能力.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
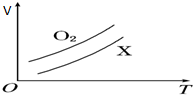 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4 (气) | B. | SO2 | C. | CH4 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述两个反应中,当有1molP参加反应时,反应转移电子数均为5NA | |
| B. | 在反应(2)中,当生成3mol硫酸时,被还原的P为1mol | |
| C. | 在上述两个反应中,P均作还原剂 | |
| D. | 在上述两个反应中,还原产物都是H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢离子结构示意图: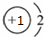 | B. | CH4分子的球棍模型: | ||
| C. | 醛基的电子式: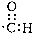 | D. | 对-硝基甲苯的结构简式: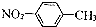 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
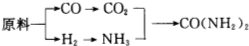
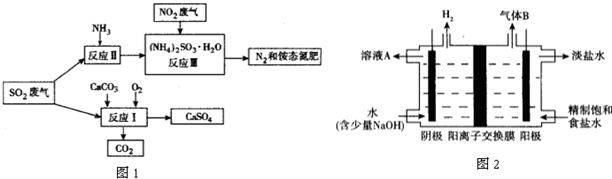
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com