
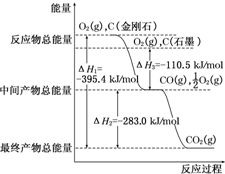
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △Hl<△H2<△H3 | D. | △H1>△H3>△H2 |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
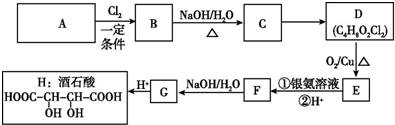
 +Cl3$\stackrel{一定条件}{→}$
+Cl3$\stackrel{一定条件}{→}$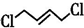
 ;
;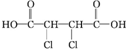 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$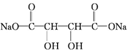 +2NaCl+2H2O;
+2NaCl+2H2O;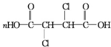 +n
+n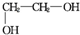 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$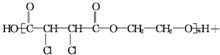
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打--NaHCO3 | B. | 胆矾--ZnSO4 | C. | 酒精--C2H5OH | D. | 生石灰--Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
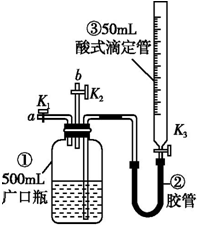 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:解答题
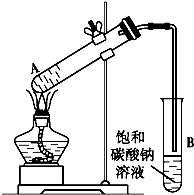 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com