
 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;| A. | CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO的燃烧热为-566 kJ/mol |
分析 A.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol;
根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2 Na2CO3(s)△H=-1018kJ/mol,根据反应计算参加反应CO物质的量;
B.由热化学方程式可知,1molCO完全燃烧放出热量283kJ;
C.固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量.
解答 解:A.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol;
根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2 Na2CO3(s)△H=-1018kJ/mol,CO(g)与Na2O2(s)反应放出509kJ热量时,则消耗CO为1mol,即28g,故A正确;
B.由热化学方程式可知,1molCO燃烧放出热量为283kJ,图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C.固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值,由2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol,所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,一氧化碳的燃烧热为283kJ/mol,故D错误.
故选AC.
点评 本题考查了热化学方程式的计算应用、盖斯定律的应用、燃烧热概念计算分析,热化学方程式的书写方法和计算应用是解题关键,题目难度中等,试题有利于培养学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
 | 1.200 | 1.000 | 0.800 | 0.600 |
| 270 | 3.60 | 3.00 | 2.40 | 1.80 |
| 280 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | 升高温度或增大A的浓度都可以增大v的值 | |
| B. | 同时改变反应温度和A的浓度,v可能不变 | |
| C. | a=6.00 | |
| D. | 270<b<280 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
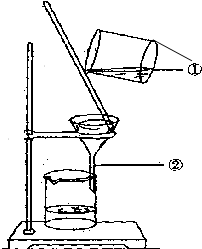 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
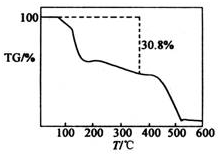 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com