
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图. 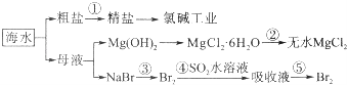
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣等离子.
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的 .
(2)除去粗盐溶液中的杂质(Mg2+、SO42﹣、Ca2+),加入药品的顺序可以为(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl26H2O制得无水MgCl2 , 应如何操作 .
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程.采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为
(5)从第③步到第④步的目的是 . 采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收.主要反应的化学方程式为 .
【答案】
(1)HCO3﹣
(2)①②④③
(3)在氯化氢气流中加热至恒重
(4)电能;化学能;MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
(5)浓缩富集溴;Br2+SO2+2H2O=H2SO4+2HBr
【解析】解:海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣等离子,可分别加热氯化钡、氢氧化钠、碳酸钠,过滤后加入盐酸,结晶得到精盐,可用于氯碱工业;母液中含有镁离子,加入氢氧化钠得到氢氧化镁,加入盐酸得到氯化镁晶体,在盐酸氛围中加热得到无水氯化镁;溴化钠中通入氯气得到溴,用二氧化硫吸收得到亚硫酸钠,继续通入氯气,得到溴,
(1.)海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、HCO3﹣等离子,在这些离子中能发生水解的是CO32﹣、HCO﹣3离子,HCO3﹣+H2OH2CO3+OH﹣它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,
所以答案是:HCO3﹣;
(2.)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:①②④⑤,
所以答案是:①②④③;
(3.)镁离子水解,应抑制其水解得到无水盐,所以利用MgCl26H2O制得无水氯化镁,应采取的措施是在HCl气流中脱水,抑制氯化镁水解,
所以答案是:在HCl气流中脱水,抑制氯化镁水解,加热至恒重;
(4.)电解原理分析,电解饱和食盐水是电能转化为化学能,采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式MgCl2 ![]() Mg+Cl2↑,
Mg+Cl2↑,
所以答案是:电能;化学能;MgCl2 ![]() Mg+Cl2↑;
Mg+Cl2↑;
(5.)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩富集溴,采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收,溴单质和二氧化硫发生氧化还原反应生成硫酸和氢溴酸,发生反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,
所以答案是:浓缩富集溴;Br2+SO2+2H2O=H2SO4+2HBr.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
Ⅰ.制备碳酸亚铁:装置如图所示.
(1)装置B中可观察到的现象是铁粉逐渐溶解,
(2)将B中生成的FeCl2溶液压入装置C的操作是
(3)Ⅱ.制备乳酸亚铁:将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
加入少量铁粉的作用是
(4)从所得溶液中获得乳酸亚铁晶体所需的实验操作是、、洗涤、干燥.
(5)设计实验证明乳酸亚铁中含 Fe2+: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是 ,氧化产物是 。
②该反应中被氧化的物质与被还原的物质物质的量之比为 。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 ,还原剂是 。
②该反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是 L。
④请把各物质填在下面空格处,需配平:
______+□______![]() □______+□______+□______+□
□______+□______+□______+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A、B的元素符号依次为、;
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(3)D的核外电子排布式为 , 在形成化合物时它的最高化合价为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁和稀硫酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.氯化铝溶液中加入过量氨水制取氢氧化铝:Al3++3NH3·H2O![]() Al(OH)3↓+3
Al(OH)3↓+3![]()
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu![]() Fe2++Cu2+
Fe2++Cu2+
D.氢氧化钠溶液中通入少量二氧化硫气体 :SO2+OH![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,则该反应的热化学方程式是( )
A.H2(g)+Cl2(g)═ ![]() HCl(g)△H=+92.4KJ/mol
HCl(g)△H=+92.4KJ/mol
B.H2(g)+Cl2(g)═ ![]() HCl(g)△H=﹣92.4KJ/mol
HCl(g)△H=﹣92.4KJ/mol
C.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.8KJ/mol
D.H2(g)+Cl2(g)═2HCl(l)△H=+184.8 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,△S<0的是( )
A.NH3(g)与HCl(g)反应生成NH4Cl(s)
B.氯化钠溶于水中
C.CaCO3(S)分解为CaO(S)和CO2(g)
D.干冰(CO2)的升华
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com