
| A、标准状况下,22.4 L C8H18中含有的共价键键数为25NA |
| B、56gFe与71g Cl2充分反应,转移了2NA个e- |
| C、22.4LNO与22.4LO2充分混合后的气体中含有3NA个O原子 |
| D、1mol/L的MgCl2溶液中含2NA个Cl- |
| m |
| M |


科目:高中化学 来源: 题型:
| A、H2+2OH--2e-=2H2O |
| B、O2+4H++4e-=2H2O |
| C、H2-2e-=2H+ |
| D、O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子及其离子的核外电子层数等于该元素所在的周期数 |
| B、元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 |
| C、稀有气体原子的最外层电子数都是8 |
| D、同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量数均为14的碳原子和氮原子表示为:614C 714N |
B、甲烷的球棍模型: |
C、甲基的结构式: |
D、甲基负离子的电子式: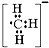 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 |
| B、装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| C、煤燃烧时加入少量的石灰石可以减少废气中的二氧化硫排放 |
| D、我国自实施“限塑令”以来,“白色污染”在一定程度上得到有效遏制 |
查看答案和解析>>
科目:高中化学 来源: 题型:

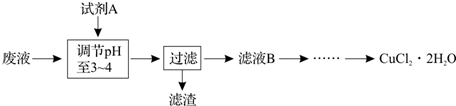

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com