
某一容器中发生如下反应:2NO(g)+O2(g)  2NO2(g); ΔH = Q kJ·mol-1,在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的关系如图所示。下列判断正确的是
2NO2(g); ΔH = Q kJ·mol-1,在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的关系如图所示。下列判断正确的是

A.p2 > p1 且Q <0
B.p2 > p1 且Q >0
C.p2 < p1 且Q <0
D.p2 < p1 且Q >0
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:2014-2015学年河南省新密市高三第三次月考化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O 反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)仪器a的名称是 ,其作用是 。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因: 。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定,滴定至终点时,消耗标准溶液的体积为18.10 mL。
反应原理为:2S2O32+I2=S4O62-+2I
(4)滴定至终点时,溶液颜色的变化: 。
(5)产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列涉及有机物的性质的说法错误的是
A.苯不能使KMnO4溶液褪色,甲苯使KMnO4溶液褪色
B.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝变成黑色
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.HNO3能与苯、甲苯等有机物发生重要反应,常用浓硫酸作催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法正确的是
A.在同温同压时,相同体积的任何气体所含的原子数目相同
B.将49g H2SO4溶于1L水中,所得溶液的物质的量浓度为0.5molL-1
C.标准状况下,11.2L水所含分子数为0.5 NA
D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高二上学期期末化学试卷(解析版) 题型:填空题
(6分)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:

根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH = -90.8kJ·mol-1
CH3OH(g) ΔH = -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH = 。
CH3OCH3(g)+CO2(g);ΔH = 。
(3)某科研机构研制的一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。该电池总反应为CH3OCH3+3O2=2CO2+3H2O,其工作原理如图所示。
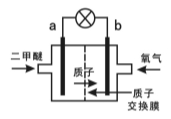
电极a的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
下列溶液一定呈中性的是
A.c (H+) × c(OH-) =10-14的溶液
B.n(H+)=n(OH—) 的溶液
C.c (H+)=1.0×10-7 mol/L的溶液
D.pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
下列物质中属于强电解质的是
A.NH3·H2O B.Cl2 C.NaCl溶液 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高一上学期期末考试化学试卷(解析版) 题型:选择题
观察丁达尔现象的正确方法是
A.观察者视线与入射胶体内一束光平行
B.将一发光的白炽灯悬在盛有胶体的烧杯正上方
C.观察者视线垂直于一束入射光,胶体置暗盒内
D.胶体置明亮背景处,观察者视线与入射胶体内的红色激光垂直
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:填空题
(10分)短周期元素W、X、Y、Z在元素周期表中的位置如右图所示。其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:


其中化合物D是一种白色沉淀,则B中溶质的化学式为 ;C转化生成D的离子方程式为 。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) = mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com