
ЁОЬтФПЁПдкT ЁцЬѕМўЯТЃЌЯђ1 LЙЬЖЈЬхЛ§ЕФУмБеШнЦїMжаМгШы2 mol XКЭ1 mol YЃЌЗЂЩњШчЯТЗДгІЃК2X(g)ЃЋY(g)![]() a Z(g)ЃЋW(g)ЁЁІЄHЃНЃQ kJЁЄmolЃ1(QЃО0ЃЌaЮЊе§ећЪ§)ЁЃЕБЗДгІДяЕНЦНКтКѓЃЌЗДгІЗХГіЕФШШСПЮЊQ1 kJЃЌЮяжЪXЕФзЊЛЏТЪЮЊІСЃЛШєЦНКтКѓдйЩ§ИпЮТЖШЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПМѕаЁЃЌдђ
a Z(g)ЃЋW(g)ЁЁІЄHЃНЃQ kJЁЄmolЃ1(QЃО0ЃЌaЮЊе§ећЪ§)ЁЃЕБЗДгІДяЕНЦНКтКѓЃЌЗДгІЗХГіЕФШШСПЮЊQ1 kJЃЌЮяжЪXЕФзЊЛЏТЪЮЊІСЃЛШєЦНКтКѓдйЩ§ИпЮТЖШЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПМѕаЁЃЌдђ
(1)ЛЏбЇМЦСПЪ§aЕФжЕЮЊ________ЁЃ
(2)ЯТСаЫЕЗЈжаФмЫЕУїИУЗДгІДяЕНСЫЛЏбЇЦНКтзДЬЌЕФЪЧ________ЁЃ
AЃЎШнЦїФкбЙЧПвЛЖЈЁЁЁЁЁЁЁЁ BЃЎШнЦїФкЦјЬхЕФУмЖШвЛЖЈ
CЃЎШнЦїФкZЗжзгЪ§вЛЖЈ DЃЎШнЦїФкЦјЬхЕФжЪСПвЛЖЈ
(3)ЮТЖШЮЌГжT ЁцВЛБфЃЌШєЦ№ЪМЪБЯђШнЦїMжаМгШыЕФЮяжЪЕФСПШчЯТСаИїЯюЃЌдђЗДгІДяЕНЦНКтКѓЗХГіЕФШШСПШдЮЊQ1 kJЕФЪЧ________(ЯЁгаЦјЬхВЛВЮгыЗДгІ)ЁЃ
AЃЎ2 mol XЁЂ1 mol YЁЂ1 mol Ar
BЃЎa mol ZЁЂ1 mol W
CЃЎ1 mol XЁЂ0.5 mol YЁЂ0.5a mol ZЁЂ0.5 mol W
DЃЎ2 mol XЁЂ1 mol YЁЂ1 mol Z
(4)ЮТЖШЮЌГжT ЁцВЛБфЃЌШєЦ№ЪМЪБЯђШнЦїMжаМгШы4 mol XКЭ6 mol YЃЌШєДяЕНЦНКтЪБШнЦїФкЕФбЙЧПМѕаЁСЫ10%ЃЌдђЗДгІжаЗХГіЕФШШСПЮЊ________kJЁЃ
(5)ЮТЖШЮЌГжT ЁцВЛБфЃЌШєдквЛИіКЭдШнЦїЬхЛ§ЯрЕШЕФКубЙШнЦїN жаЃЌМгШы2 mol XКЭ1 mol YЗЂЩњШчЩЯЗДгІВЂДяЦНКтЃЌдђ________(бЁЬюMЛђN)ШнЦїжаЕФЗДгІЯШДяЕНЦНКтзДЬЌЃЌШнЦїжаXЕФжЪСПЗжЪ§M________N(бЁЬюЃОЁЂЃМЁЂЃНЗћКХ)ЁЃ
(6)вбжЊЃКИУЗДгІЕФЦНКтГЃЪ§ЫцЮТЖШЕФБфЛЏШчЯТБэЃК
ЮТЖШ/Ёц | 200 | 250 | 300 | 350 |
ЦНКтГЃЪ§K | 9.94 | 5.2 | 1 | 0.5 |
ШєдкФГЮТЖШЯТЃЌ2 mol XКЭ1 mol YдкШнЦїMжаЗДгІДяЦНКтЃЌ XЕФЦНКтзЊЛЏТЪЮЊ50%ЃЌдђИУЮТЖШЮЊ________ЁцЁЃ
ЁОД№АИЁП1ACAQNЃО350
ЁОНтЮіЁП
ЃЈ1ЃЉЗДгІЗХШШЃЌШєЦНКтКѓдйЩ§ИпЮТЖШЃЌдђЦНКтЯђзѓвЦЖЏЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПМѕаЁЃЌЫЕУїЗДгІЮяЦјЬхЕФЛЏбЇМЦСПЪ§жЎКЭДѓгкЩњГЩЮяЦјЬхЕФЛЏбЇМЦСПЪ§жЎКЭЃЌМД2+1ЃОa+1ЃЌдђa=1ЃЌЙЪД№АИЮЊЃК1ЃЛ
ЃЈ2ЃЉA.гЩгкЗДгІЧАКѓЦјЬхЕФЛЏбЇМЦСПЪ§жЎКЭВЛЯрЕШЃЌдђЦНКтЪБбЙЧПВЛдйЗЂЩњБфЛЏЃЌЙЪAе§ШЗЃЛB.гЩгкЪЧдкЙЬЖЈЬхЛ§ЕФШнЦїжаЗДгІЃЌдђЮоТлЪЧЗёДяЕНЦНКтзДЬЌЃЌУмЖШЖМВЛБфЃЌЙЪBДэЮѓЃЛC.ЗДгІДяЕНЦНКтзДЬЌЪБЃЌЮяжЪЕФХЈЖШЁЂКЌСПЁЂжЪСПЕШВЛдйЗЂЩњБфЛЏЃЌдђЦНКтЪБШнЦїФкZЗжзгЪ§вЛЖЈЃЌЙЪCе§ШЗЃЛD.ЗДгІЮяКЭЩњГЩЮяЖМЪЧЦјЬхЃЌЮоТлЪЧЗёДяЕНЦНКтзДЬЌЃЌШнЦїФкЦјЬхЕФжЪСПЖМвЛЖЈЃЌЙЪDДэЮѓЃЛЙЪД№АИЮЊЃКACЃЛ
ЃЈ3ЃЉвђШнЦїЬхЛ§ВЛБфЃЌГфШыЯЁгаЦјЬхЖдЦНКтЮогАЯьЃЌЗХГіЕФШШСПВЛБфЃЌЙЪAе§ШЗЃЛЗДгІДгФцЗДгІПЊЪМЃЌЗДгІЮќЪеШШСПЃЌЙЪBДэЮѓЃЛCжаЦ№ЪММгШыСПгыЬтИЩЕШаЇЃЌЕЋДцдкЩњГЩЮяЃЌДяЦНКтЪБЗХГіЕФШШСПОљаЁгкQ1kJЃЌЙЪCДэЮѓЃЛDжаЯрЕБгкдЦНКтЪБГфШыСЫZЃЌЦНКтФцЯђвЦЖЏЃЌДяЦНКтЪБЗХГіЕФШШСПОљаЁгкQ1kJЃЌЙЪDДэЮѓЃЛЙЪД№АИЮЊЃКAЃЛ
ЃЈ4ЃЉЩшзЊЛЏЕФXЕФЮяжЪЕФСПЮЊ2amolЃЌдђгаЃК
2X(g)+Y(g)![]() Z(g)+W(g) ЁїH=-QkJmol-1(QЃО0)
Z(g)+W(g) ЁїH=-QkJmol-1(QЃО0)
Ц№ЪМ(mol) 4 6 0 0
зЊЛЏ(mol) 2a a a a
ЦНКт(mol) 4-2a 6-a a a
гЩЧАКѓЕФбЙЧПжЎБШЕШгкЮяжЪЕФСПжЎБШПЩЕУЃК![]() =90%ЃЌдђa=1ЃЌЙЪзЊЛЏЕФXЮЊ2molЃЌгЩШШЛЏбЇЗНГЬЪНПЩЕУДЫЪБЗХГіЕФШШСПЮЊQkJЃЌЙЪД№АИЮЊЃКQЃЛ
=90%ЃЌдђa=1ЃЌЙЪзЊЛЏЕФXЮЊ2molЃЌгЩШШЛЏбЇЗНГЬЪНПЩЕУДЫЪБЗХГіЕФШШСПЮЊQkJЃЌЙЪД№АИЮЊЃКQЃЛ
ЃЈ5ЃЉИУЬѕМўЯТЃЌКубЙгыКуШнЯрБШЃЌЯрЕБгкдіДѓбЙЧПЃЌбЙЧПдНДѓЃЌЗДгІЫйТЪдНДѓЃЌЗДгІЕНДяЦНКтЕФЪБМфдНЖЬЃЌдіДѓбЙЧПЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђXЕФжЪСПЗжЪ§МѕаЁЃЌЙЪД№АИЮЊЃКNЃЛЃОЃЛ
ЃЈ6ЃЉ2molXКЭ1molYдкШнЦїMжаЗДгІВЂДяЕНЦНКтЃЌxЕФЦНКтзЊЛЏТЪЮЊ50%ЃЌ
2XЃЈgЃЉ+YЃЈgЃЉ![]() ZЃЈgЃЉ+WЃЈgЃЉ
ZЃЈgЃЉ+WЃЈgЃЉ
Ц№ЪМЃЈmolЃЉЃК2 1 0 0
зЊЛЏЃЈmolЃЉЃК1 0.5 0.5 0.5
ЦНКтЃЈmolЃЉЃК1 0.5 0.5 0.5
ЦНКтГЃЪ§k=![]() =
=![]() =0.5ЃЌ ЫљвдЦфЮТЖШЪЧ350ЁцЃЌЙЪД№АИЮЊЃК350ЁцЁЃ
=0.5ЃЌ ЫљвдЦфЮТЖШЪЧ350ЁцЃЌЙЪД№АИЮЊЃК350ЁцЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪФмДйНјЫЎЕФЕчРыЕФЪЧЃЈ ЃЉ
A.CH3COOHB.NaOHC.NH4ClD.Na2SO4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪГфЗжЗДгІКѓЙ§ТЫЃЌНЋТЫвКМгШШЁЂеєИЩжСжЪСПВЛБфЃЌзюжеВЛФмЕУЕНДПОЛЮяЕФЪЧ( )
A. ЯђКЌ1 mol Ca(HCO3)2ЕФШмвКжаМгШы1 mol Na2O2
B. ЯђДјгабѕЛЏФЄЕФТСЦЌжаМгШыбЮЫс
C. ЯђЦЏАзЗлШмвКжаЭЈШыЙ§СПCO2
D. ЯђКЌ1 mol KAl(SO4)2ЕФШмвКжаМгШы2 mol Ba(OH)2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШЛЏЬњЪЧГЃМћЕФЫЎДІРэМСЃЌЙЄвЕЩЯжЦБИЮоЫЎFeCl3ЕФвЛжжЙЄвеШчЯТЃК
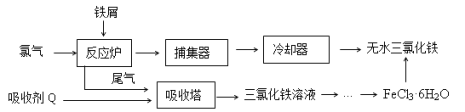
ЃЈ1ЃЉгЩFeCl3ЁЄ 6H2OОЇЬхжЦБИЮоЫЎFeCl3гІВЩШЁЕФДыЪЉЪЧЃК ЁЃ
ЃЈ2ЃЉСљЫЎКЯТШЛЏЬњдкЫЎжаЕФШмНтЖШШчЯТЃК
ЮТЖШ/Ёц | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
ШмНтЖШЃЈg/100gH2OЃЉ | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
ДгFeCl3ШмвКжЦЕУFeCl3ЁЄ6H2OОЇЬхЕФВйзїВНжшЪЧЃКМгШыЩйСПбЮЫсЁЂ ЁЂ ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЃ
ЃЈ3ЃЉГЃЮТЯТЃЌШєШмвКЕФpHПижЦВЛЕБЛсЪЙFe3+ГСЕэЃЌpHЃН4ЪБЃЌШмвКжаcЃЈFe3+ЃЉЃН molЁЄL-1ЁЃЃЈГЃЮТЯТKsp[FeЃЈOHЃЉ3]ЃН2.6ЁС10-39ЃЉЁЃ
ЃЈ4ЃЉFeCl3ЕФжЪСПЗжЪ§ЭЈГЃПЩгУЕтСПЗЈВтЖЈЃКГЦШЁ2.300gЮоЫЎТШЛЏЬњбљЦЗЃЌШмгкЯЁбЮЫсЃЌ дйзЊвЦЕН100mLШнСПЦПЃЌгУеєСѓЫЎЖЈШнЃЛШЁГі10.00mLЃЌМгШыЩдЙ§СПЕФKIШмвКЃЌГфЗжЗДгІКѓЃЌЕЮШыФГвЛжИЪОМСВЂгУ0.1000molЁЄL-1Na2S2O3ШмвКЕЮЖЈгУШЅ12.50mLЁЃ
вбжЊЃКI2ЃЋ2S2O32ЃЃН2IЃЃЋS4O62-
Ђй аДГіМгШыЩдЙ§СПЕФKIШмвКЗДгІЕФРызгЗНГЬЪНЃК ЁЃ
Ђк ЧѓбљЦЗжаТШЛЏЬњЕФжЪСПЗжЪ§ЃЈаДГіМЦЫуЙ§ГЬЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇРћгУШчЯТЭМЫљЪОзАжУЭъГЩСЫХЈСђЫсКЭSO2ЕФаджЪЪЕбщ(МаГжзАжУвбЪЁТд)ЁЃЧыЛиД№ЯТСаЮЪЬт

(1)НЋТна§зДЕФЭЫПЩьШыХЈСђЫсжаЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____________ЁЃ
(2)ЪЕбщжаЃЌЪдЙмЂђжаЕФЦЗКьШмвК_____________(ЬюЯжЯѓ)ЁЃ
(3)ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ_______(ЬюзжФИДњКХ)
A.ЗДгІКѓЃЌНЋЪдЙмIжаЕФвКЬхж№ЕЮМгШыЫЎжаЃЌШмвКГЪРЖЩЋ B.ЪдЙмЂѓжаГіЯжАзЩЋЛызЧ
C.ЪдЙмЂєжаЕФЫсадKMnO4ШмвКЭЪЩЋ D.ЪдЙмVжаЕФNaOHШмвКгУгкЮќЪеЮВЦј
(4)ШєЗДгІжага0.02 mol H2SO4БЛЛЙдЃЌдђЗДгІВњЩњЕФЦјЬхЬхЛ§ЮЊ______mL(БъзМзДПіЯТ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіе§ШЗЕФЪЧ
A. 24 g УОгы27 gТСжаЃЌКЌгаЯрЭЌЕФжЪзгЪ§
B. ЭЌЕШжЪСПЕФбѕЦјКЭГєбѕжаЃЌЕчзгЪ§ЯрЭЌ
C. 1 molжиЫЎгы1 molЫЎжаЃЌжазгЪ§БШЮЊ2ЁУ1
D. 1 molввЭщКЭ1 molввЯЉжаЃЌЛЏбЇМќЪ§ЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкЛЏбЇЗДгІжаЕФФмСПБфЛЏЃЌЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ( )
A. ШМЩеЗДгІЖМЪЧЗХШШЗДгІ
B. ЖдгкПЩФцЗДгІЃКaA(g)+bB(g)![]() bC(g)+dD(g)ЃЌШчЙће§ЗДгІЗХШШЃЌФцЗДгІвЛЖЈЮќШШ
bC(g)+dD(g)ЃЌШчЙће§ЗДгІЗХШШЃЌФцЗДгІвЛЖЈЮќШШ
C. ЧтЦјШМЩеЩњГЩЫЎЪЧвЛИіЗХШШЕФЛЏбЇЗДгІЃЌЫЕУї1 mol H2ЕФФмСПИпгк1 mol H2OЕФФмСП
D. жЛгаЗХШШЕФбѕЛЏЛЙдЗДгІВХПЩвдЩшМЦЮЊдЕчГи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІ![]() ЃЈЁїHЃМ0ЃЉдкЕШШнЬѕМўЯТНјааЁЃИФБфЦфЫћЗДгІЬѕМўЃЌдкЂёЁЂЂђЁЂЂѓНзЖЮЬхЯЕжаИїЮяжЪХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЯТЭМЫљЪОЃК
ЃЈЁїHЃМ0ЃЉдкЕШШнЬѕМўЯТНјааЁЃИФБфЦфЫћЗДгІЬѕМўЃЌдкЂёЁЂЂђЁЂЂѓНзЖЮЬхЯЕжаИїЮяжЪХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЯТЭМЫљЪОЃК

ЛиД№ЮЪЬтЃК
ЂХЗДгІЕФЛЏбЇЗНГЬЪНжаaЁУbЁУcЮЊЃЛ
ЂЦЃСЕФЦНОљЗДгІЫйТЪvЂёЃЈAЃЉЁЂvЂђЃЈAЃЉЁЂvЂѓЃЈAЃЉДгДѓЕНаЁХХСаДЮађЮЊЃЛ
ЂЧЃТЕФЦНКтзЊЛЏТЪІСЂёЃЈBЃЉЁЂІСЂђЃЈBЃЉЁЂІСЂѓЃЈBЃЉжазюаЁЕФЪЧЃЌЦфжЕЪЧЃЛ
ЂШгЩЕквЛДЮЦНКтЕНЕкЖўДЮЦНКтЃЌЦНКтвЦЖЏЕФЗНЯђЪЧЃЌВЩШЁЕФДыЪЉЪЧЃЛ
ЂЩБШНЯЕкЂђНзЖЮЗДгІЮТЖШЃЈЃдЃВЃЉКЭЕкЂѓНзЖЮЗДгІЮТЖШЃЈЃдЃГЃЉЕФИпЕЭЃЛЃдЃВЃдЃГЃЈЬюЁАЃМЁБЁАЃОЁБЁАЃНЁБЃЉХаЖЯЕФРэгЩЪЧЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП100mLУмЖШЮЊ1.84g/cm3ЃЌжЪСПЗжЪ§ЮЊ98%ЕФХЈСђЫсжаЃЌc(H2SO4ЃЉЪЧ( )
A. 18.4 B. 9.8molЁЄLЁЊ1 C. 1.84molЁЄLЁЊ1 D. 18.4molЁЄLЁЊ1
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com