
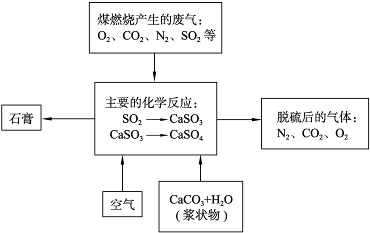
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
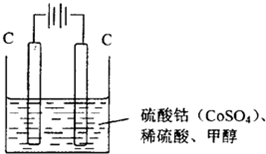
 (2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( ) (2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
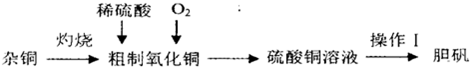
 (2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.
(2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
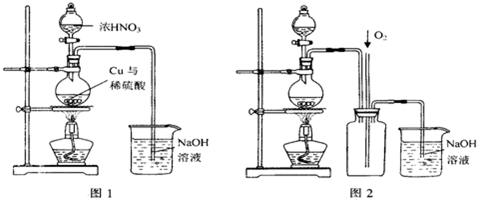
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ④ |
| ⑤KMnO4/H+ |
| ⑥ |
| ⑦酸化 |
| 一定条件 |
| 一定条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com