
����Ŀ��(1)��ҵ�����ѿ�ʯ(��Ҫ�ɷ�ΪFeTiO3����Ҫ��FeO��Al2O3��SiO2������)�������������Ƶ�TiO2:

���У�����II��������Ҫ��ӦΪ:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
�ٲ���I������Ӧ�����˷���ʽ��:_____________��___________��Ϊ����ѿ�ʯ�ļ�������ʣ�����I�ɲ�ȡ�İ취������Ũ���⣬�����Բ�ȡ�İ취��_________________��__________________________(д�����ַ���)��
�ڲ���II�м���Fe��Ŀ����___________________�������FeSO4����IJ�����___________��
�۲���III�γɵ�TiO2��nH2O Ϊ���壬�䷴Ӧ�Ļ�ѧ����ʽΪ____________________��
(2)������TiO2ͨ���������ַ����Ʊ�������:
����һ: ��TiO2��������ʯī������������CaOΪ���Һ��̼�������۳أ����TiO2�Ƶ��ѣ�������һ�����ɵ�������____________���������ɵ�������__________________��
������: ͨ�����·�Ӧ�Ʊ�������
��TiO2 (s)+2Cl2(g)![]() TiCl4(g)+O2(g) ��H=+ 151kJ/mol
TiCl4(g)+O2(g) ��H=+ 151kJ/mol
��TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
ʵ�������У����ڷ�Ӧ�ٹ����м���̼������˳���Ƶ�TiCl4��̼�����ó�ȼ�շ����⣬�����е�������_______________________________________��
���𰸡� Al2O3+2OH-=2A1O2-+H2O SiO2+2OH-=SiO32-+H2O �����¶�(�����) �����ʯ����� ��ԭFe3+ ���� TiOSO4+(n+1)H2O![]() TiO2��nH2O(����)+H2SO4 O2������ CO2(��CO��CO2��CO) ����O2���ٽ��к�������Ӧ�����ƶ�
TiO2��nH2O(����)+H2SO4 O2������ CO2(��CO��CO2��CO) ����O2���ٽ��к�������Ӧ�����ƶ�
�������������������1���ٸ��ݶ����������������Ʒ�Ӧ���ɹ����ƺ�ˮ�����������������Ʒ�Ӧ����ƫ�����ƺ�ˮ������Ӱ�췴Ӧ���ʵ����ط�������ѿ�ʯ�ļ�������ʵķ�������Fe�ܰ�Fe3+��ԭΪFe2+�������FeSO4�������ڹ�Һ��������TiOSO4ˮ��ΪTiO2��nH2O(����)����2������������ʧ���ӷ���������Ӧ����������������C���ʷ�Ӧ����CO��CO2������̼�����������ٽ�ƽ���ƶ�������
��������1������������������������ܺ�ǿ�ᷴӦ���ܺ�ǿ�Ӧ�����κ�ˮ����Ӧ���ӷ���ʽ��Al2O3+2OH-=2A1O2-+H2O����������������������ܺ�ǿ�Ӧ���ɹ����ƺ�ˮ����Ӧ���ӷ���ʽ��SiO2+2OH-=SiO32-+H2O�������¶Ȼ�����ʯ����趼������ѿ�ʯ�ļ������������Fe�ܰ�Fe3+��ԭΪFe2+������II�м���Fe��Ŀ���ǻ�ԭFe3+�������FeSO4�����ù��˷�����TiOSO4ˮ��ΪTiO2��nH2O(����)�Ļ�ѧ����ʽΪTiOSO4+(n+1)H2O![]() TiO2��nH2O(����)+H2SO4����2������������ʧ���ӷ���������Ӧ����������������C���ʷ�Ӧ����CO��CO2������������һ�����ɵ��������������������ɵ�������CO��CO2������̼����O2���ٽ��к�������Ӧ�����ƶ���
TiO2��nH2O(����)+H2SO4����2������������ʧ���ӷ���������Ӧ����������������C���ʷ�Ӧ����CO��CO2������������һ�����ɵ��������������������ɵ�������CO��CO2������̼����O2���ٽ��к�������Ӧ�����ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ���1������ͼ��8��װ���У�����ԭ��ص���____________��

��2������������ԭ��Ӧ��2Ag��(aq)��Zn(s)===Zn2��(aq)��2Ag(s)��Ƶ�ԭ�����ͼ��ʾ����ش��������⣺

���缫X�IJ�����______���������ҺY��________��
�����缫Ϊ��ص�______���������ĵ缫��ӦΪ__________________��
��3������ɻ�������ȼ�ϵ����Ϊ������Դ��ȼ�ϵ��һ��ָ����H2��CH4��CO��C2H5OH�ȿ�ȼ������O2һ�ɵĵ��װ�ã�����ֱ�ӽ���ѧ��ת��Ϊ���ܡ���ͼ�Ǽ���ȼ�ϵ��ԭ��ʾ��ͼ���ش��������⣺

����صĸ�����____(����a������b��)���ü��ĵ缫��Ӧ��____________��
�����ı�״����5.6 L O2ʱ����____mol���ӷ���ת�ơ�
����ʼ�ŵ�ʱ������������Һ��pH__________(��������������С������������)
����ͭΪ�缫���ô˵������Դ�����������Һ����ʼ�η�����ӦCu��2H2O===Cu(OH)2��H2������______________��
A��ϡH2SO4 B��NaOH��Һ C��Na2SO4��Һ
D��CuSO4��Һ E��NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1-������������Ũ���������£�ͨ��������Ӧ�Ƶ����ᶡ������Ӧ�¶�Ϊ115��125�棬��Ӧװ����ͼ�����жԸ�ʵ��������������
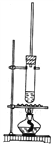
A. ������ˮԡ����
B. ����������������������
C. Ϊ�ᴿ���ᶡ��������ˮ��̼������Һϴ��
D. ͨ���������1-��������������ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. 28g��ϩ�����Ĺ��õ��Ӷ���ĿΪ2NA
B. 133.5AlCl3���庬�е�������ĿΪ4NA
C. 0.1molCl2������ʯ���鷴Ӧ��ת�Ƶ��ӵ���ĿΪ0.2NA
D. 4.6gNO2��N2O4��ɵĻ�����庬�е���ԭ����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����:Ksp(PbI2)=4��10-6��Ksp(PbS)=8��10-28��ȡ������ɫPbI2�������Ƴ�100mL��Һ�����ƹ�������Һ������Ũ����ʱ��ı仯��ϵ��ͼ��ʾ������˵������ȷ����

A. A�㴦�ɱ�ʾPbI2�IJ�������Һ
B. Tʱ���п������PbI2��Һ�м�����KI����
C. ������PbI2������Һ�е�c(I-)=10-2mol/L
D. ��A�㴦��PbI2��Һ�м���100mL 2��10-3mol/L��Na2S��Һ,ƽ�����Һ�е�c(Pb2+)<4��10-3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������Ҵ���ͬϵ��
B. ���ͼױ������ڱ�����
C. �л�������һ������̼Ԫ��
D. ����̼Ԫ�صĻ�����һ�����л�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��ԭ���������ε�����ǰ������Ԫ�أ�AԪ�ص������ϼ��븺���ϼ۵Ĵ�����Ϊ�㣻BԪ��ԭ�ӵļ۵��ӽṹΪnsnnpn��CԪ�ػ�̬ԭ��s�ܼ��ĵ���������p�ܼ��ĵ���������1��DԪ��ԭ�ӵ�M�ܲ�ȫ���������ֻ��һ�����ӡ���ش�:
��1��AԪ�صĵ���ΪA2�������γ�A3��A4���������˹��ۼ���___�ԣ�BԪ�ص��ʵ�һ�ֿռ���״�ṹ�ľ����۵�>3550�����õ��ʵľ�����������________����̬Dԭ�ӹ���___�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2��A��C�γɵ�����ӵ�����ԭ���ӻ���ʽ��___________���÷�����D2+��H2O��2:1:2����Ƚ���γɵ���������_________(�ѧʽ)�����������е���������IJ�֮ͬ��Ϊ_____(����)��
������ԭ�ӵļ۲���Ӷ��� ������ԭ�ӵŵ��ӶԵĶ��� ������ԭ�ӵĻ�ѧ������ ��VSEPRģ��
��3��1molBC���к��е�������ĿΪ______��д����BC-��Ϊ�ȵ�����ķ��Ӻ����Ӹ�һ��______��______��
��4��D2+�������ξ�����۵��D2+�������ξ�����۵�ߣ���ԭ����______��
��5��D3C�������õĵ�ѧ��ѧ���ܣ��侧��ľ����ṹ��ͼ��ʾ��D+��C3���뾶�ֱ�Ϊapm��bpm��D+��C3�����ǽ��ܽӴ��ĸ���С����C3������λ��Ϊ_____��������ܶ�Ϊ____g��cm-3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��â����ѧʽΪNa2SO410H2O����ɫ���壬������ˮ����һ�ֲַ��ܹ㷺�������ο����С��ͬѧ���룬���ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������ͼ��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ��� 
��1���õ��۵�������ӦʽΪ �� ��ʱͨ�������ӽ���Ĥ��������������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
��2���Ƶõ�����������Һ�ӳ��ڣ��A������B������C����D����������
��3��ͨ�翪ʼ������������ҺpH�����������ԭ�� ��
��4�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ �� ��֪H2��ȼ����Ϊ285.8kJmol��1 �� ���ȼ�ϵ�ع�������36g H2Oʱ���������� kJ������ת��Ϊ���ܣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йش����Ĵ�������������Դӡ��Ҵ�������ʵ�顱�õ�һЩ��ʶ��ij��ʦ�������ͼװ�ã��г�װ��������ʡ�ԣ�����ʵ�����Ϊ���Ȱ�ͼ��װ�ã��ȹرջ���a��b��c����ͭ˿���м䲿�ּ���Ƭ�̣�Ȼ�����a��b��c��ͨ�����ƻ���a��b�����н��ࣨ��Ъ�ԣ�ͨ�����壬������M���۲쵽���Ե�ʵ������

��1��A�з�����Ӧ�Ļ�ѧ����ʽ��_______________________________ ��B�����ã�________________________��
��2��M�������ķ�Ӧ�Ļ�ѧ����ʽΪ��______________________________________
��3����ʵ������д���______________ ����μӡ����μӡ����˻�ѧ��Ӧ
��4���Ҵ�����������_____________���Ҵ����Ժ����Ը��������Һ��Ӧ��ֱ��������Ϊ______________________��
��5�����Թ�F���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����____��Ҫ��ȥ�����ʣ������ڻ��Һ�м���_____����д��ĸ����
A���Ȼ�����Һ B���� C��̼��������Һ D�����Ȼ�̼
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com