
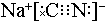 ��̼Ԫ�صĻ��ϼ�Ϊ+2����ClO2����й©���軯�ƣ��õ�����NaCl��N2��CO2��������4��10-5mol•L-1�ķ�ˮ1000L��������ҪClO2������Ϊ2.7g��
��̼Ԫ�صĻ��ϼ�Ϊ+2����ClO2����й©���軯�ƣ��õ�����NaCl��N2��CO2��������4��10-5mol•L-1�ķ�ˮ1000L��������ҪClO2������Ϊ2.7g�� ���� ��1����ȼ�����ɹ������ƣ����������������̼��Ӧ����������̼���ƣ�
��2��������Ӧ��Ԫ�ػ��ϼ۱仯������������ԭ��Ӧ��ʧ�����غ㡢ԭ�Ӹ����غ���ƽ����ʽ��
��3�����ݻ������и�Ԫ�ػ��ϼ۴�����Ϊ0�ж�̼Ԫ�ػ��ϼۣ���ClO2 ����й©���軯�ƣ�NaCN�����õ�����NaCl��N2 ��CO2���÷�Ӧ��ClԪ�ػ��ϼ���+4�۱�Ϊ-1�ۡ�NԪ�ػ��ϼ���-3�۱�Ϊ0�ۣ�CԪ�ػ��ϼ���+2�۱�Ϊ+4�ۣ�����ת�Ƶ����غ���ƽ����ʽ���ٸ����������ƺͶ������ȵĹ�ϵʽ���㣮
��� �⣺��1����ȼ�����ɹ������ƣ�����ʽ��2Na+O2$\frac{\underline{\;��ȼ\;}}{\;}$Na2O2�����������������̼��Ӧ����������̼���ƣ�����ʽ��2Na2O2+2CO2=2Na2CO3+O2��
�ʴ�Ϊ��2Na+O2$\frac{\underline{\;��ȼ\;}}{\;}$Na2O2��2Na2O2+2CO2=2Na2CO3+O2��
��2����Ӧ����Ԫ�ش�+3������Ϊ+6�ۣ����������������Ԫ�ش�+1�۽�Ϊ-1�ۣ�Ҫʹ��ʧ�����غ㣬������������ϵ��Ϊ2�������������ϵ��Ϊ3������ԭ�Ӹ����غ㷴Ӧ�ķ���ʽ��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O��
�ʴ�Ϊ��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O��
��3���軯������Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ-3�ۣ����ݻ��ϼ۴�����Ϊ0����֪̼Ԫ��Ϊ+2�ۣ�
��ClO2 ����й©���軯�ƣ�NaCN�����õ�����NaCl��N2 ��CO2���÷�Ӧ��ClԪ�ػ��ϼ���+4�۱�Ϊ-1�ۡ�NԪ�ػ��ϼ���-3�۱�Ϊ0�ۣ�CԪ�ػ��ϼ���+2�۱�Ϊ+4�ۣ�����ת�Ƶ����غ���ƽ����ʽ2ClO2+2NaCN=2NaCl+N2+2CO2��n��NaCN��=4��10-5mol•L-1��1000L=0.04mol�����ݷ���ʽ֪�����Ķ����������ʵ���Ϊ0.04mol��������=0.04mol��67.5g/mol=2.7g��
�ʴ�Ϊ��+2��2.7g��
���� ���⿼����������ԭ��Ӧ����ʽ����д���йؼ��㣬��ȷ������ԭ��Ӧ��ʧ�����غ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
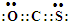 ��
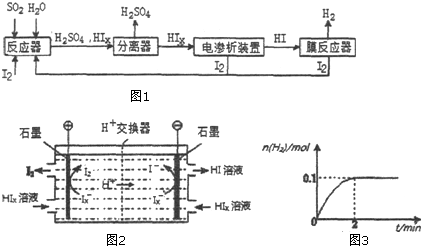
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���¶��µ�ƽ�ⳣ��Ϊ101.25 L/moL | |
| B�� | �ﵽƽ��ʱ��SO2��ת������90% | |
| C�� | �����¶ȣ�����Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶ȴ� | |
| D�� | ��ƽ��������ͨ�����BaCl2��Һ�У��õ�����������Ϊ231.4g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | HA���ʵ���Ũ�ȣ�mol•L1�� | NaOH���ʵ���Ũ�ȣ�mol•L��1�� | �����Һ��pH |
| �� | 0.2 | 0.2 | a |
| �� | c1 | 0.2 | 7 |
| �� | 0.1 | 0.1 | 7 |
| �� | 0.1 | 0.1 | 9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
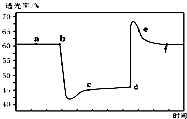 ��֪��Ӧ��2NO2��g��+4CO��g��?N2��g��+4CO2��g����H��0����һ������NO2��CO����װ�д�����ע�����к��ڣ���ͼ���������ѹ��ע�����Ĺ���������������ʱ��ı仯��������ɫԽ�����ԽС��������˵������ȷ���ǣ�������
��֪��Ӧ��2NO2��g��+4CO��g��?N2��g��+4CO2��g����H��0����һ������NO2��CO����װ�д�����ע�����к��ڣ���ͼ���������ѹ��ע�����Ĺ���������������ʱ��ı仯��������ɫԽ�����ԽС��������˵������ȷ���ǣ�������| A�� | b��IJ����ǿ���ѹ��ע���� | |
| B�� | c����a����ȣ�c��NO2����c��N2�������� | |
| C�� | e�㣺�ԣ��������ԣ��棩 | |
| D�� | ��������ϵ�¶ȱ仯����û��������ʧ����ƽ�ⳣ��K��c����K��f�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 molAl3+���Ӻ��еĺ��������Ϊ3NA | |
| B�� | 1.7gH2O2�к��еĵ�����Ϊ0.9NA | |
| C�� | �����£�11.2L�ļ������庬�м��������Ϊ0.5NA�� | |
| D�� | ��״���£�33.6LH2O����9.03��1023��H2O���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
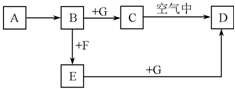 A��G����ѧ��ѧ�г��������ʣ���һ������������֮���ת����ϵ��ͼ��ʾ������AΪ������F��һ���ж������嵥�ʣ�GΪNaOH��Һ��
A��G����ѧ��ѧ�г��������ʣ���һ������������֮���ת����ϵ��ͼ��ʾ������AΪ������F��һ���ж������嵥�ʣ�GΪNaOH��Һ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com