
【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
【答案】C
【解析】
A.碳酸氢钠与盐酸反应生成二氧化碳和氯化钠和水,方程式NaHCO3+HCl=NaCl+CO2↑+H2O,碳酸氢钠与与氢氧化钠反应生成碳酸钠,方程式NaHCO3+NaOH=Na2CO3+H2O,符合题中转化关系,故A不符合题意;
B.氧化铝与盐酸反应生成氯化铝,方程式为6HCl+Al2O3═3H2O+2AlCl3,氧化铝与氢氧化钠反应生成偏铝酸钠,方程式Al2O3+2NaOH=2NaAlO2+H2O,符合题中转化关系,故B不符合题意;
C.铝与盐酸反应生成氯化铝,方程式为6HCl+2Al═3H2↑+2AlCl3,铝与氢氧化钠反应只能生成偏铝酸钠,不能生成氢氧化铝,故C符合题意;
D.氢氧化铝与盐酸反应生成氯化铝,方程式为3HCl+Al(OH)3═3H2O+AlCl3,氢氧化铝与氢氧化钠反应生成偏铝酸钠,方程式Al(OH)3+NaOH=NaAlO2+2H2O,符合题中转化关系,故D不符合题意;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列对污水处理的化学方法及其原理的描述错误的是( )
A. 明矾放入污水中就会发生反应: Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B. 用氢氧化钙来中和钢铁厂、电镀厂产生的酸性废水,用硫酸或CO2中和碱性废水
C. 利用沉淀反应是除去水中重金属离子常用的方法
D. 处理含有重金属离子的废水一定不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )

A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对应的离子方程式正确的是( )
A.酸性高锰酸钾溶液和草酸溶液反应:2![]() +16H++5
+16H++5![]() ═2Mn2++10CO2↑+8H2O
═2Mn2++10CO2↑+8H2O
B.向氯化铁溶液中通入过量二氧化硫:2Fe3++3SO2+6H2O═2Fe+3![]() +12H+
+12H+
C.银和稀硝酸反应:3Ag+4H++![]() ═3Ag++2H2O+NO↑
═3Ag++2H2O+NO↑
D.向氯水中加入碳酸钠:Cl2+![]() ═Cl-+ClO-+CO2↑
═Cl-+ClO-+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4xH2O)的工艺流程如下:
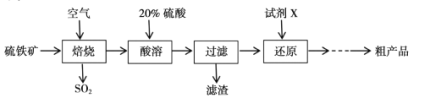
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____。
(2)写出酸溶过程主要反应的离子方程式____。
(3)试剂X是(写化学式)____。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4xH2O)的操作是____
(5)利用如图装置测定FeSO4xH2O中结晶水含量:
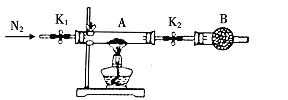
实验前通入N2,的主要目的是____,装置B中盛放的试剂是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,其中C、D、E同周期,A、C同主族,B、E同主族,B元素的原子最外层电子数是次外层电子数的三倍,又知A单质是密度最小的气体。
请回答下列问题:
(1)元素C在周期表中的位置______________________________。
(2)A、C、E以原子个数比1∶1∶1形成化合物X,其电子式为_________________。
(3)B、E对应简单氢化物稳定性的大小顺序是(用分子式表示) ________________。
(4)若D是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
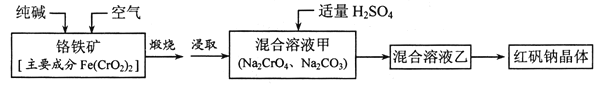
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________Fe(CrO2)2+Na2CO3+O2![]() Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )。
为阿伏加德罗常数的值。下列说法正确的是( )。
A.![]() 与
与![]() 的混合物,含离子总数为
的混合物,含离子总数为![]()
B.已知![]() 中铬元素的化合价为
中铬元素的化合价为![]() 价,则
价,则![]() 分子中存在的过氧键数目为
分子中存在的过氧键数目为![]()
C.![]() 溶液完全反应,转移电子数目一定为
溶液完全反应,转移电子数目一定为![]()
D.常温时,![]() 的盐酸中水电离的
的盐酸中水电离的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是现代钢铁生产的重要环节,此法工艺简单,产量大,能耗低,仍是现代炼铁的主要方法,回答下列问题:
(1)已知炼铁过程的主要反应为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1
还会发生3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=a kJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=b kJ/mol;
FeO(s)+CO(g)=Fe(s)+ CO2(g) △H4=c kJ/mol;
则△H1=________kJ/mol(用含a、b、c的代数式表示)。
(2)高炉炼铁产生的废气(CO、CO2)有多种处理方法,反应原理如下:
①生成甲醇:CO(g)+2H2(g)![]() CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
A.υ(CO)=1.2 mol/(L·min) B.υ(H2)=0.025 mol/(L·s) C.υ(CH3OH)=1 mol/(L·min)
②生成乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
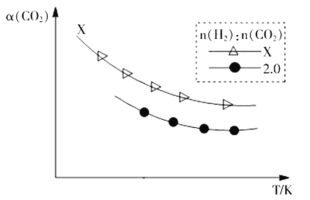
氢碳比X_____2.0(填>、<或=,下同),理由是___________________。
(3)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
T/℃ | 700 | 800 | 1000 | 1200 |
K | 0.6 | 1.0 | 2.3 | 3.6 |
①该反应是___________反应(填“吸热”或“放热”)。
②若某恒定温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2、3 mol H2,10 min后反应达到平衡状态,测得υ (CH3OH)=0.075 mol/(L·min),则此反应条件下温度______800℃(填>、<或=)。
③若反应在1200℃进行试验,某时刻测得反应容器中各物质浓度满足关系式2c(CO2)·c3(H2)=3c(CH3OH)·c(H2O),此时反应在________向进行(填“正”或“逆”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com