
分析 (1)金属/空气燃料电池中,氧化剂是空气中氧气;
(2)Al/空气燃烧碱性电池中,Al失电子作负极,正极上氧气得电子和水反应生成氢氧根离子;负极上Al失电子发生氧化反应,碱性条件下生成偏铝酸根离子;
(3)电解氧化铝冶炼Al时,阴极上电极反应式为Al3++3e-=Al,根据Al和转移电子之间的关系式计算.
解答 解:(1)金属/空气燃料电池中,空气中氧气具有强氧化性,常常作氧化剂,所以该燃料电池中,氧化剂是空气中氧气,故答案为:氧气;
(2)Al/空气燃烧碱性电池中,Al失电子作负极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;负极上Al失电子发生氧化反应,碱性条件下生成偏铝酸根离子,电极反应式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:O2+2H2O+4e-=4OH-;Al-3e-+4OH-=AlO2-+2H2O;
(3)电解氧化铝冶炼Al时,阴极上电极反应式为Al3++3e-=Al,根据Al和转移电子之间的关系式知,生成1mol铝转移3mol电子,若有6mol电子发生转移,则在阴极上得到金属铝的物质的量是2mol,其质量=2mol×27g/mol=54g,
故答案为:54.
点评 本题考查原电池原理、物质的量的有关计算等知识点,明确各个电极上发生的反应是解本题关键,注意(2)中负极反应式的书写,为易错点,电极反应式的书写要结合电解质溶液酸碱性,题目难度不大.


科目:高中化学 来源: 题型:填空题
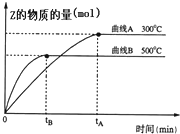 向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.
向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为①>②>③ | |
| B. | 等物质的量浓度的Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)<c(H+)+c(HCO3-)+3c(H2CO3) | |
| C. | 0.1 mol•L-1KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-2c(C2O42-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
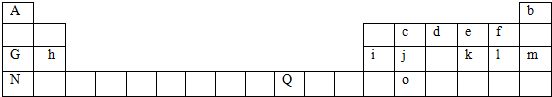
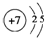 ,其气态氢化物溶于水显碱性.(填“酸”或“碱”)
,其气态氢化物溶于水显碱性.(填“酸”或“碱”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
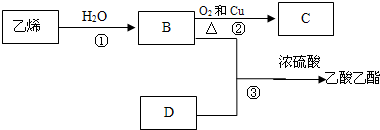
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com