
| A. | 2mol/L | B. | 1.2mol/L | C. | 0.8mol/L | D. | 无法确定 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、NH4+、NO3-、HCO3- | |
| B. | 能使甲基橙变红的溶液中:Na+、K+、SO42-、AlO2- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液中:H+、Ca2+、SCN-、Cl- | |
| D. | 0.1mol•L-1AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体100g | |
| B. | 定容时俯视观察刻度线 | |
| C. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤 | |
| D. | 定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
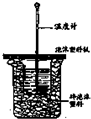 用如图实数装置进行中加热测定实验,请回答下列问题:
用如图实数装置进行中加热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com