
分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,HCl中氯元素化合价由-1价升高为Cl2中0价;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各中一半;
(3)反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+C12↑+2H2O中,产生6.72L即0.3mol气体,则生成氯气为0.1mol,据此计算转移电子物质的量.
解答 解:(1)反应中2KClO3中氯元素化合价由+5价降低为2ClO2中+4价,则氧化剂为2KClO3,2HCl中氯元素化合价由-1价升高为Cl2中0价,则还原剂为2HCl,所以氧化剂和还原剂之比是1:1,故答案为:1:1;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各中一半,故选:①③;
(3)反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+C12↑+2H2O中,产生6.72L即0.3mol气体,则生成氯气为0.1mol,又HCl中氯元素化合价由-1价升高为Cl2中0价,所以转移的电子的物质的量为0.1mol×2=0.2mol,
故答案为:0.2mol.
点评 本题以氯气的制法来考查了氧化还原反应的知识,注意把握氧化还原反应中转移的电子数的计算,明确化合价的变化是分析的关键,题目难度中等.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的大小 | B. | 能否透过滤纸或半透膜 | ||
| C. | 是否为大量分子或离子的集合法 | D. | 能否产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的分子式:CH3COOH | B. | 甲烷的结构简式:CH4 | ||
| C. | 35Cl表示该氯原子核内有20个中子 | D. | SiO2是二氧化硅的分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.
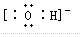 ,F粒子是
,F粒子是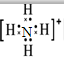 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3NA | |
| C. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.1lNA | |
| D. | 1L0.01mol/LKAl(SO4)2溶液中含有的阳离子数为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com